
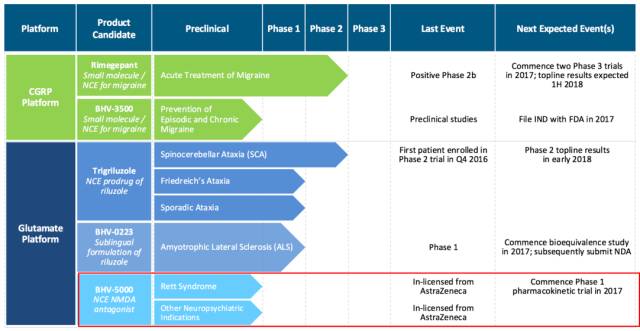
Biohaven公司近日宣布,美国食品与药物管理局(英语:U.S. Food and Drug Administration,FDA)授予该公司谷氨酸调制平台临床研究性化合物BHV-5000治疗雷特综合征(Rett syndrome)患者的孤儿药地位。这是该公司第四个获得FDA孤儿药地位的产品。
雷特综合征是一种罕见而严重的遗传性神经发育障碍,几乎只影响女性。在表面上正常的产后发育后,患者会在6-18个月大时出现症状。雷特综合征患者会出现精神运动功能的全面减速,丧失已获得的认知技能(比如语言和有目的的手部运动),还会出现大脑介导的短暂呼吸抑制发作。
患者可能会生存到成年,但会存在严重的身体和认知损害。雷特综合征在美国影响大约15000人。目前还没有获批治疗雷特综合征的药物,而且护理是支持性的。
“BHV-5000是一种新型谷氨酸拮抗剂,Biohaven公司计划跨多个适应症评估该药物的疗效,”Biohaven公司首席执行官VladCoric说,“我们针对雷特综合征的临床开发项目特别重要,因为患者及其家人们目前还没有获批治疗这种重症神经发育障碍的药物。BHV-5000获得的治疗雷特综合征的孤儿药地位,支持了Biohaven公司为罹患一些致残性最强神经疾病的患者提供改善疗法的全球发展战略。”
孤儿药地位的潜在益处包括:税收抵免50%临床试验费用,免除上市申请用户费用(估计节约超过200万美元),如果最终获得监管批准,将拥有7年的市场独占权。
“雷特综合征患者会出现令人衰弱的症状,”Biohaven公司首席医疗官RobertBerman博士说,“对BHV-5000的临床前研究已经证明其对雷特综合征转基因小鼠模型的益处,特别是对呼吸异常症状的影响。我们渴望在雷特综合征患者中进行测试,以了解这些临床前效果能否转化为对患者的治疗益处。”
图片来源:Biohaven公司官网
Biohaven公司预计将在2017年针对健康志愿者发起一项有商业准备配方的BHV-50001期试验,然后在2018年针对雷特综合征患者进行研究。
关于Biohaven公司
Biohaven是一家临床阶段生物制药公司,拥有一系列靶向治疗神经系统疾病(包括罕见病)的创新性、后期候选产品。Biohaven将内部开发研究与从其他公司和机构获得知识产权许可相结合,包括百时美施贵宝、阿斯利康、耶鲁大学、康泰伦特、罗格斯大学、ALS Biopharma LLC公司、麻省总医院等。目前,Biohaven的领先开发项目包括跨其CGRP受体拮抗剂和谷氨酸调制平台的多种化合物。
关于BHV-5000
BHV-5000是一种低捕获性、强力N-甲基-D-天(门)冬氨酸(NMDA)受体拮抗剂,2016年10月从阿斯利康获得许可。BHV-5000之前已经进入1期研究,其活性代谢物lanicemine之前已经通过2期研究。与其他此类制剂不同的是,BHV-5000是一种低捕获的NMDA拮抗剂,与干扰其他NMDA靶向化合物的显著的拟精神病影响没有联系。此外,BHV-5000是口服生物可利用的。
关于孤儿药地位
FDA通过其孤儿产品开发办公室(OOPD)授予药物和生物产品孤儿地位,所涉及的产品是为了安全有效地治疗、诊断、预防罕见病或在美国影响少于200000人的疾病。孤儿药地位为药物开发商提供了一些益处和激励措施,包括产品最终获得监管批准治疗相应适应症后一段时间的市场独占权。
原文链接:
http://investors.biohavenpharma.com/news-releases/2017/07-06-2017-075959756
-------------------
原文翻译/曹文东
校审/夏蓓
本文由中国罕见病网编译,转载请注明出处。