时间过得飞快,转眼2017年已经接近尾声。在刚刚过去的11月份,美国FDA共计批准了6款新药,保持了今年一直以来的良好势头。扳着手指算一下,过去11个月中,FDA总共批准了41款新药,这个数字已接近去年的两倍,预计今年批准的新药数量将超过45个。
审批速度依旧给力,6款新药陆续问世
表1:2017年11月FDA批准的6款新药
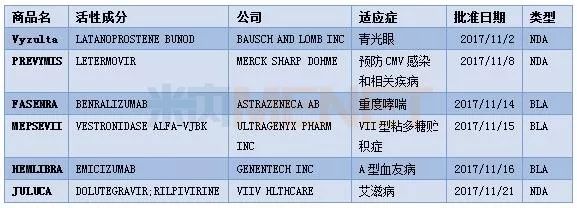
在这6款新药中,没有抗癌药物在列,这和之前的10个月稍微有些不同(之前10个月抗癌药物占据了较大比重,共计11款抗癌新药)。其中,3款罕见病新药的批准再次反映出美国对于罕见病患者的重视。
喜讯不断,多个适应症领域均有斩获
1. 首款治疗青光眼的前列腺素类似物:Latanoprostene Bunod
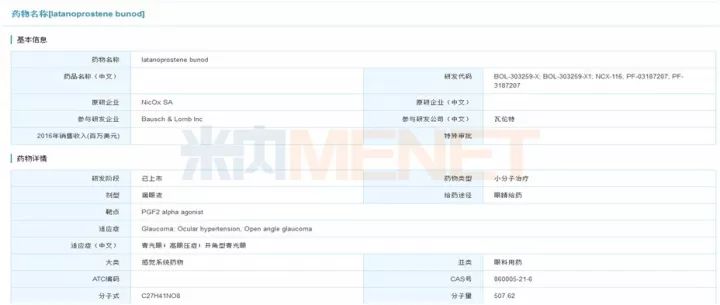
Latanoprostene Bunod最初由辉瑞和NicOx合作研发,2010年NicOx公司授权给博士伦公司。该药于2017年11月2日获得美国FDA批准上市,由博士伦在美国上市销售,商品名为Vyzulta。Vyzulta是首款获批上市,用于青光眼的前列腺素类似物。该药物的有效成分拉坦前列素酸(latanoprost acid)和丁二醇单硝酸酯(butanediol mononitrate),在青光眼的治疗上有着双重作用机制。Vyzulta既能作用于葡萄膜巩膜通路,又能通过释放一氧化氮作用于小梁网和许莱姆氏管(Schlemm's canal),促进房水排出。在一系列临床试验中,Vyzulta展现出非常出色的疗效,与马来酸噻吗洛尔滴眼液相比,Vyzulta展现出了非劣效与优效性;与拉坦前列素相比,Vyzulta能更显著地降低眼压。此外,它的短期疗效与长期安全性也得到了证实。在中国有超过千万的青光眼患者,希望这款新药能早日在国内上市,造福大众。
图1:米内网全球研发库搜索结果
(点击图片可放大)
2.新型非核苷类CMV抑制剂:Letermovir
Letermovir最初由AiCuris研发,2011年授权给默沙东,于2017年11月8日获得美国FDA批准上市,商品名是Prevymis。该药是一种新的非核苷类CMV抑制剂(3,4-二氢喹唑啉),通过靶向病毒终止酶(terminase)复合物抑制病毒的复制。FDA批准了PREVYMI(letermovir)口服片剂和静脉注射液两种剂型,用于巨细胞病毒(CMV)血清阳性的同种异体造血干细胞(HSCT)成人受者,以预防巨细胞病毒感染的治疗。在美国,欧盟和日本,Letermovir被授予孤儿药资格,用于预防巨细胞病毒疾病,并正在欧盟和日本加速审查。该药具有一定的市场潜力,预计未来五年市场销售额能达到1.6亿美元。
图2:米内网全球研发库搜索结果
(点击图片可放大)
3.哮喘患者的福音:Benralizumab
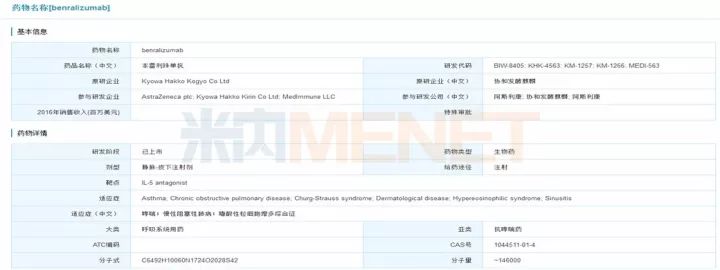
Benralizumab最初由BioWa公司(日本协和发酵麒麟株式会社的成员)研发,之后授权给MedImmune公司(阿斯利康的子公司)进行哮喘相关研究。该药于2017年11月14日获得美国FDA批准上市,商品名为Fasenra,用于12岁以上严重嗜酸粒细胞性哮喘患者的治疗。Fasenra是一种可以直接与嗜酸性粒细胞白介素-5α受体(interleukin-5 receptor)结合的人源化单克隆抗体,通过组织自然杀伤细胞诱导嗜酸性粒细胞的凋亡(程序性细胞死亡),是目前唯一一款可以在24小时之内将嗜酸性粒细胞直接、快速和近乎完全清除的呼吸疾病治疗用生物药物。众所周知,哮喘药物市场竞争十分激烈,这一市场中已经充斥了葛兰素史克、梯瓦和诺华等强有力的竞争者,阿斯利康的Fasenra的市场前景也没有想象中的乐观(阿斯利康宣称Fasenra最大销售额能达到20亿美元),预计其未来五年市场销售额峰值为8亿美元。
图3:米内网全球研发库搜索结果
(点击图片可放大)
4.治疗VII型粘多糖贮积症新药:Vestronidase alfa-vjbk
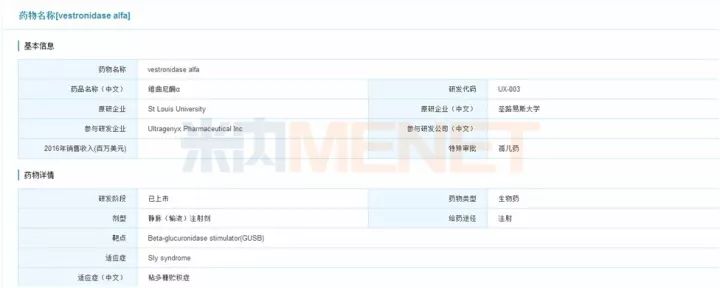
Vestronidase alfa-vjbk由 Ultragenyx公司开发,于2017年11月15日获得美国FDA批准上市,商品名为Mepsevii。Vestronidase alfa-vjbk是一种重组人β葡糖醛酸糖苷酶,可替代缺失的溶酶体酶,降解组织中的粘多糖,用于治疗儿童和成人VII型黏多糖贮积症这一极其罕见的疾病。Mepsevii曾获得美国 FDA颁发的孤儿药资格以及快速通道资格,它的获批充分说明了美国对罕见病新药研究的重视。
图4:米内网全球研发库搜索结果
(点击图片可放大)
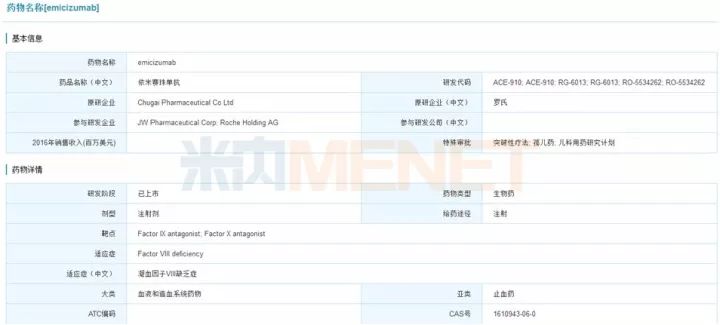
5.20年来首个血友病重磅新药: Emicizumab
Emicizumab由中外制药开发(罗氏子公司),于2017年11月16日获得美国FDA批准上市,商品名为Hemlibra,用于A型血友病患者的治疗。Hemlibra是双特异性因子IXa和因子X定向抗体,它可以将激活天然凝血级联所需的蛋白质因子IXa和因子X聚集在一起,恢复A型血友病患者的凝血过程。Hemlibra是20年来首个血友病新药,是该领域的重大突破。A型血友病影响全球大约32万人,其中50%-60%的人具有该病的严重形式,这一患者群体还有巨大的医疗需求未被满足。Hemlibra的出现给A型血友病带来了更多的希望,业内人士也对其市场前景相当看好,预计未来五年市场销售额峰值能达到30亿美元。
图5:米内网全球研发库搜索结果
(点击图片可放大)
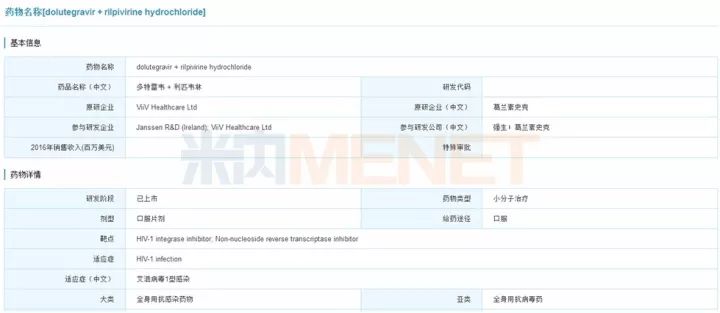
6.抗艾滋病双重药物组合疗法:Juluca
美国FDA于2017年11月21日批准ViiV Healthcare(GSK子公司)共同开发的新药Juluca上市,用于感染HIV-1特定成人患者的治疗。值得一提的是,这是首个获批用于治疗艾滋病的的双药疗法,与三种或四种药物组合疗法的副作用相比更低。这款新药由dolutegravir与rilpivirine组成,临床研究表明,其能有效抑制HIV病毒,效果与这些受试者曾使用的抗HIV疗法相当,同时限制HIV疗法中的药物数量能有效减少对患者的毒性。
Juluca只是GSK开发抗击艾滋病病毒的双药组合中的一个,另一个双药组合dolutegravir + lamivudine目前正处于临床三期,如果临床试验成功,预计可以在2019年下半年上市。丰富的产品管线,使得GSK可以与其主要竞争对手吉利德在抗艾滋病领域上分庭抗礼。
图6:米内网全球研发库搜索结果

(点击图片可放大)
结语
2017年11月份,在这短短的一个月中,美国FDA批准了6款新药,其中包括重磅炸弹药物Emicizumab。6款新药涉及多个治疗领域,其中3款罕见病新药的批准也是美国对罕见病患者充分重视的例证。国内罕见病药物研究与美国等发达地区差距甚大,希望在国家和药企的努力下,能让更多罕见病患者用上救命药。逐利而行,亦能兼济天下!