6月19日,Alexion宣布提交长效补体C5抑制剂 ravulizumab (ALXN1210) 的上市申请,用于治疗阵发性睡眠性血红蛋白尿症(paroxysmal nocturnal hemoglobinuria, PNH)。
Alexion之前因为推出2款罕见病药物获得了2张宝贵的优先审评券,此次递交ravulizumab的上市申请时使用了一张,可以使ravulizumab的审批时间(从提交BLA资料到完成审批)从常规的12个月缩短到8个月 。
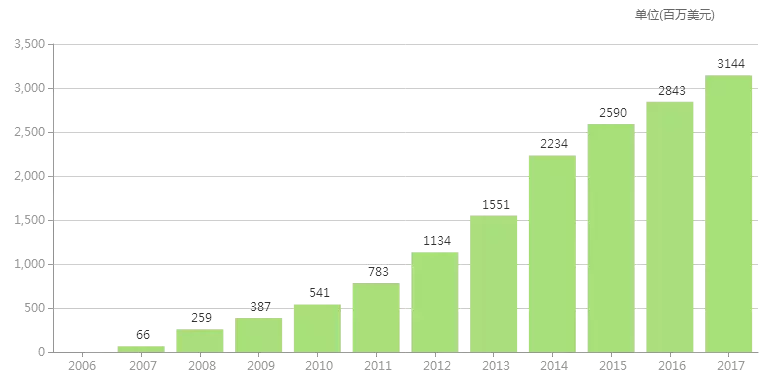
Alexion是补体生物学研究的先驱,开发上市了全球首个补体C5抑制剂Soliris(依库珠单抗),用于治疗阵发性睡眠性血红蛋白尿症、非典型溶血尿毒综合征、重症肌无力。Soliris是最高的药物之一,治疗PNH每年的费用要50万美元,2017年销售额达到31.44亿美元。
Soliris历年销售额(百万美元)
ravulizumab和Soliris同样属于补体C5抑制剂,不过更加长效,只需每8周静脉注射1次,与每2周注射1次的Soliris相比,将每年的给药次数从26次减少到6次。
Alexion此次提交申请主要基于在PNH患者中开展的最大规模的两项III期研究的结果,共入组超过440例患者。第1项研究入组的是从未接受过补体抑制剂治疗的患者。第2项研究入组的是经Soliris治疗(每2周1次)后疾病稳定并转为ALXN1210治疗(每8周注射1次)的患者。结果显示,两项研究均到达主要终点,ALXN1210组在输血患者比例、乳酸脱氢酶(LDH)恢复正常患者比例的主要终点方面不劣于Soliris。
事实上,Alexion认为ALXN1210在各个疗效指标上都比Soliris更为出色,而且可以更快使患者的LDH水平(PNH的生物标志物)恢复到正常水平。Alexion计划年中和下半年分别向欧盟EMA及日本提交ALXN1210 上市申请。ALXN1210 在美国和欧盟均获得了治疗PNH的孤儿药资格。