Sobi是一家致力于罕见病新药研发的国际生物制药公司。近日该公司宣布,旗下瑞士生物技术公司Novimmune SA研制的一款新药Gamifant(emapalumab-lzsg)已获得美国食品和药物管理局(FDA)批准,该药是一种干扰素γ(INFγ)阻断抗体,用于难治性、复发性或进展性疾病或对常规HLH疗法不耐受的原发性噬血细胞性淋巴组织细胞增多症(HLH)儿童(新生儿及以上)和成人患者的治疗。之前,FDA已授予Gamifant孤儿药资格、突破性药物资格、罕见儿科疾病资格、优先审查资格。此次批准,使Gamifant成为全球首个专门针对HLH的药物,标志着原发性HLH临床治疗领域24年来的首个重大突破。
HLH是一种非常罕见的高发病率和高死亡率的高度炎症综合征,以前一直没有获批的治疗药物。临床治疗方面,HLH的近期治疗目标为迅速控制炎性急症,并未造血干细胞移植做准备,这是唯一的治疗方法。目前,在移植前使用的常规诱导疗法包括甾体类和化学疗法,但这些药物未被特别批准用于治疗HLH。
HLH是一种免疫调节紊乱性疾病,其中许多细胞因子紊乱,但IFNγ似乎起着关键作用。虽然很早就知道IFNγ在HLH中的关键作用,但在Gamifant获批之前,还没有一种药物可以特异性地靶向这个靶点。Gamifant具有一种靶向作用模式,该药的获批,标志着原发性HLH临床治疗的一个重大里程碑。
Gamifant由Novimmune SA公司研制。今年7月,Sobi以4.52亿美元收购Novimmune SA,获得了这款药物。该笔收购包括一笔5000万美元的预付款,以及4亿美元的里程碑金。Sobi公司已计划,在2019年初将Gamifant推向美国市场,该公司预计这款药物的销售峰值将达到3.3亿美元。本月初,Sobi还与阿斯利康签署了一笔总价23亿美元的协议,获得了呼吸道感染药物Synagis(palivizumab)和另一款待批呼吸道感染药物MEDI8897(由阿斯利康与赛诺菲合作开发)在美国市场50%的利润分层权益。
Gamifant的获批,是基于一项全球性、多中心、开放标签、单臂关键性II/III期临床研究(NCT01818492)的数据。该研究入组了34例原发性HLH患者。Gamifant的疗效在一个由27例难治性、复发性、或接受常规HLH疗法期间病情进展或对常规HLH疗法不耐受患者组成的队列中进行了评价,这意味着这些患者对常规疗法无应答、未获得满意应答、未维持满意应答或不能耐受。研究中,Gamifant于地塞米松同时用药,其中地塞米松剂量在研究期间可以逐渐降低。
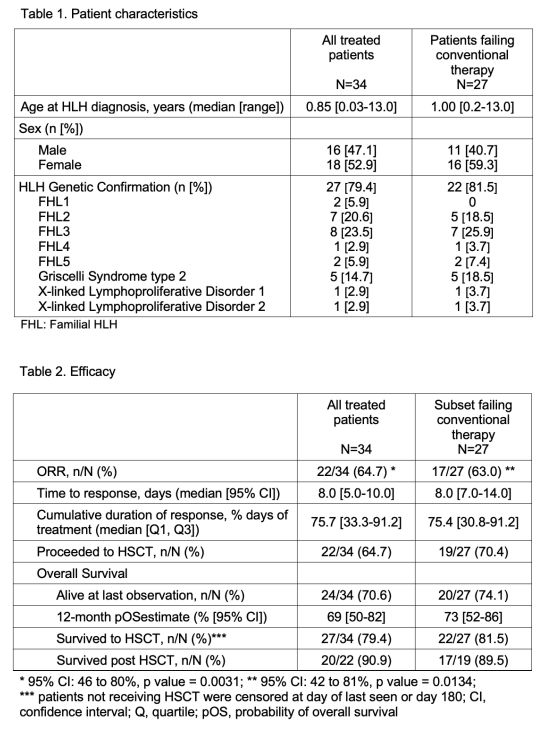
数据显示,该研究达到了主要终点。根据下月初将在美国血液学会(ASH)公布的数据:(1)整个研究患者组(n=34)中,治疗结束时的总缓解率为64.7%(n=22/34,p=0.0031)、达到缓解的中位时间为8.0天、累计缓解时间占治疗时间的75.7%、有64.7%的患者(n=22/34)继续接受了造血干细胞移植、患者移植后的存活率为90.9%(n=20/22);(2)难治性队列(n=27)中,治疗结束时的总缓解率为63.0%(n=17/27,p=0.0134)、达到缓解的中位时间为8.0天、累计缓解时间占治疗时间的75.4%、有70.4%的患者(n=19/27)继续接受了造血干细胞移植、患者移植后的存活率为89.5%(n=17/19)。
此外,整个研究患者组(n=34)中,有79.4%(n=27/34)的患者经基因检测诊断为原发性HLH,而难治性队列中有81.5%(n=22/27)为原发性HLH。研究期间报告的最常见的不良反应为感染(056%)、高血压(41%)、输液相关不良反应(27%)和发烧(24%)。
原文出处:
1、FDA Approves Gamifant® (emapalumab-lzsg), the First and Only Treatment Indicated for Primary Hemophagocytic Lymphohistiocytosis (HLH)
2、LBA-6 Safety and Efficacy of Emapalumab in Pediatric Patients with Primary Hemophagocytic Lymphohistiocytosis