
今日,诺华(“Novartis”)宣布,公司临床阶段创新药iptacopan(LNP023)胶囊,获得国家药品监督管理局药品审评中心(CDE)突破性治疗药物认定,用于治疗阵发性睡眠性血红蛋白尿症(PNH)。这是继2022年3月iptacopan继C3肾小球病(C3G)适应症后,再次获CDE突破性治疗药物认定。
关于Iptacopan
Iptacopan是一款首创(first-in-class)、口服、强效、选择性、小分子、可逆性补体因子B(FB)抑制剂。FB是补体系统替代途径的关键丝氨酸蛋白酶,iptacopan通过作用于补体系统C5末端通路的上游,阻断溶血性 PNH 成人的血管内溶血(IVH)和血管外溶血(EVH);它可能在治疗多种替代通路功能异常导致的疾病同时,不影响其它补体通路介导的对微生物入侵的免疫反应,降低患者受到感染的风险。此前,iptacopan获FDA和EMA突破性疗法认定,用于治疗PNH和C3G;同时,该药物获得FDA罕见儿科疾病认定,治疗C3G。
2022年10月,诺华宣布iptacopan在治疗此前未接受过补体抑制剂治疗的PNH患者中的3期APPLY-PNH 研究达到两项主要终点。APPLY-PNH 是一项 III 期、随机、多中心、活性对照、开放标签试验,旨在评估每日两次口服 iptacopan 治疗 PNH 的疗效和安全性。根据2022 ASH公布的数据:
主要终点:
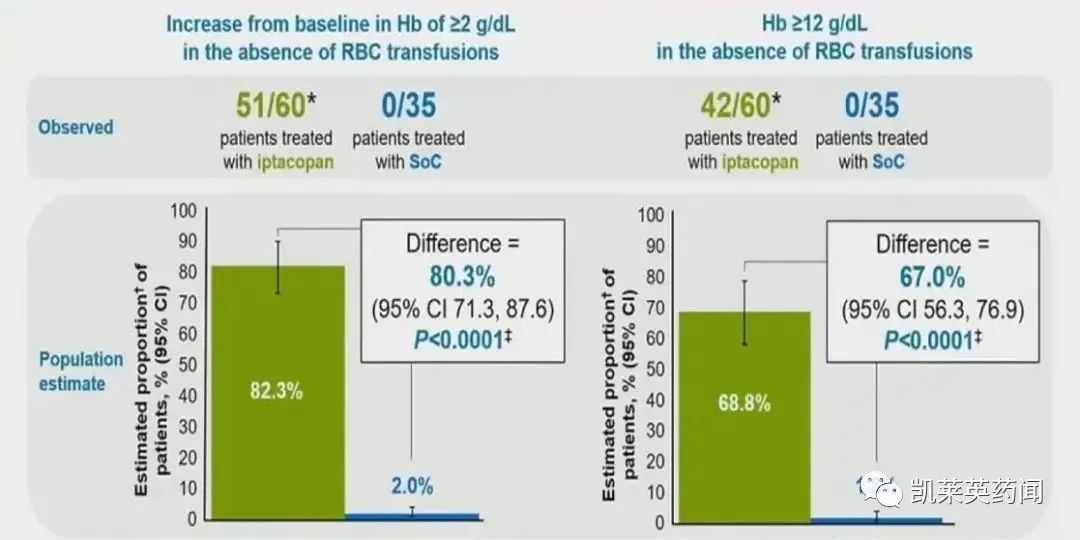
1、第24周,接受Iptacopan治疗后血红蛋白水平较基线升高≥ 2 g/dl的患者比例显著高于接受C5标准治疗的对照组(P < 0.0001),且无需继续输血治疗(RBCT)。
2、第24周,接受Iptacopan治疗后血红蛋白水平持续≥ 12 g/dl的患者比例显著高于接受标准治疗的对照组(P < 0.0001),且无需继续RBCT。
次要终点:
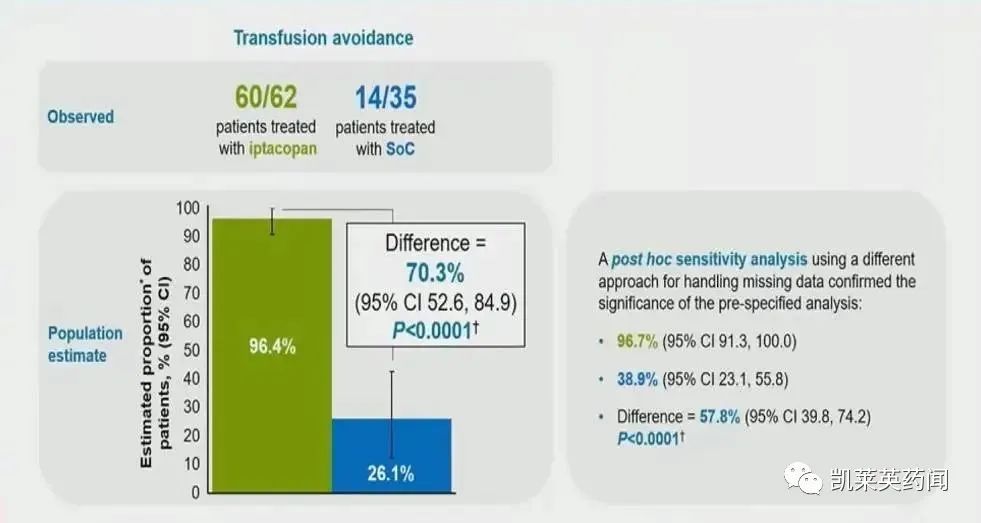
1、第24周,Iptacopan治疗组中无需RBCT的患者比例为60/62,而标准治疗组中的患者比例为14/35。
2、第24周,Iptacopan单药治疗在血红蛋白水平较基线的变化、FACIT-疲劳评分、网织红细胞计数(ARC)、临床突破性溶血(BTH)发生率等方面也表现有统计学差异。
在安全性上,无死亡病例,无严重荚膜细菌感染。
除PNH之外,iptacopan针对其它补体介导疾病(CMD)的开发也处于在研阶段,包括C3G、IgA肾病(IgAN)、非典型溶血性尿毒症综合征(aHUS)、狼疮性肾炎(LN)和冷凝集素病(CAD)等。
关于补体因子B
补体系统是先天免疫系统的一部分,补体由经典通路、替代通路和凝集素通路三种途径之一激活,产生一系列蛋白水解裂解,以增强免疫反应或形成膜攻击复合体(MAC)。C1处于经典通路的上游,C3属于三条通路的汇集点,而C5则位于通路末端。在正常情况下,血管内溶血由CD59阻断,CD59能阻止补体反应的最后一步,即阻止在靶细胞上形成孔的MAC。倘若患者红细胞缺乏,将CD59连接至其表面的GPI锚而导致血管内溶血;靶向末端补体C5能阻止MAC复合物的形成,阻断血管内溶血。
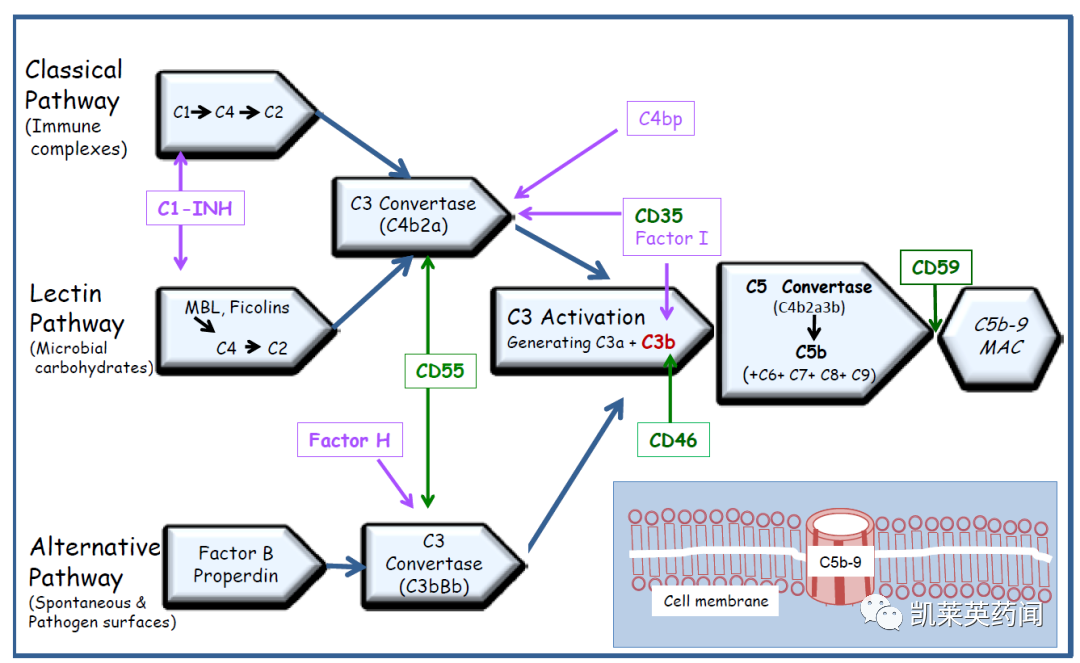
补体因子B是一种丝氨酸蛋白酶,是调节补体旁路途径级联反应的必需蛋白,在此过程中,补体因子B 被补体因子D分解为两个亚基 Ba 和 Bb。Bb 与C3b 一起形成了替代途径的 C3 转化酶 C3bBb,然后形成C5 转化酶(C3bBbC3b),最终形成膜攻击复合物。
据不完全统计,目前针对补体因子B开发的在研药物约10余种,研究类型涵盖小分子抑制剂、单抗、反义疗法、RNAi等。
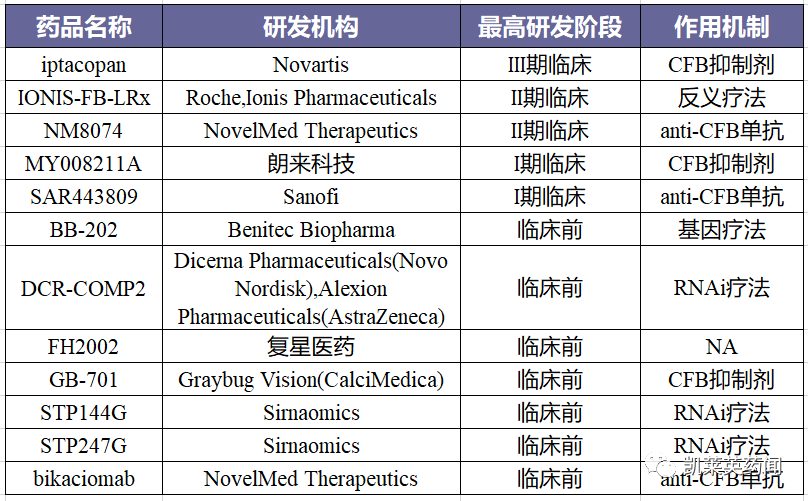
关于PNH
PNH是一种由于体细胞Xp22.1上PIG—A基因突变导致的获得性造血干细胞克隆性疾病。其发病机制包括造血干细胞 PIG—A基因突变,使部分或完全血细胞膜糖化磷脂酰肌醇(GPI)锚合成障碍,造成血细胞表面 GPI锚连蛋白缺失,细胞灭活补体等能力减弱,从而引起细胞容易被破坏,发生溶血等。临床主要表现为不同程度的发作性血管内溶血、阵发性血红蛋白尿、骨髓造血功能衰竭和静脉血栓形成。
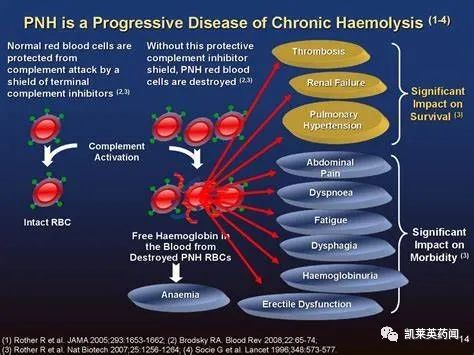
据统计,发病率约百万分之一到二,亚洲人群发病率高于欧美。PNH可在任何年龄发生,常见于30-40岁人群除了骨髓移植,PNH尚无其他有效治愈手段,控制溶血发作是临床上治疗该病的主要手段,主要治疗药物包括糖皮质激素、免疫抑制剂、补体通路抑制剂等,其中抗补体C5药物是其当前标准疗法。
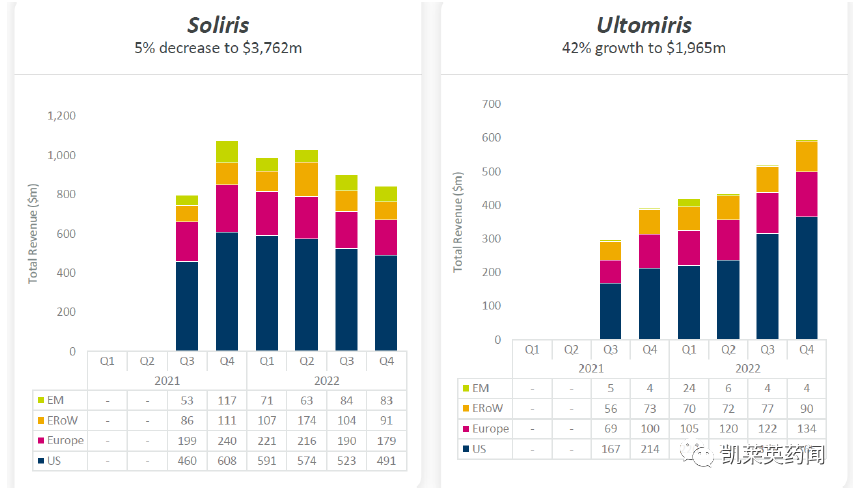
目前,全球获批治疗PNH的补体C5抑制剂药物仅有Soliris (eculizumab)、和Ultomiris (ravulizumab),这两款药物均由阿斯利康开发,通过静脉注射给药。
Soliris:是全球批准的首款补体C5抑制,除获批治疗PNH,还被批准用于治疗非典型aHUS,抗乙酰胆碱受体(AchR)抗体阳性的重症肌无力(MG)以及抗水通道蛋白-4(AQP4)抗体阳性且伴有复发病程的视神经脊髓炎谱系障碍(NMOSD),每周或每2周给药一次。2022年总收入高达37.62 亿美元。
Ultomiris:是Soliris升级版产品,目前已被批准用于治疗PNH、aHUS(成人和≥1个月儿科患者)和全身型重症肌无力(gMG)。2022年总收入高达19.65亿美元。
抗补体C5疗法是既往国际公认的PNH标准治疗,但在抗C5治疗后,仍有大部分患者有残留贫血、疲乏和输血依赖,严重影响生活质量。