微生物和人类杠上了。
毋庸置疑,微生物影响人类的健康这一观念越来越深入人心。然而,寄居在人体的数千种微生物总量与我们体内的细胞数量几乎一样多,具体到每一种微生物与人体健康之间的关系,依旧鲜为人知。近年来,越来越多的科学家开始寻找与每一种疾病有关的微生物。在他们看来,如果能找到跟疾病直接相关的微生物,那么我们就能找到治疗疾病的方法。

近期科学家已经有一些重磅发现,例如,他们发现了引起肠炎的特定微生物,找到了与汉族人肥胖有关的肠道微生物,还找到了促进肠癌和胰腺癌耐药的微生物。这些新发现不仅解释了疾病或者耐药性发生的原因,也为疾病的治疗提供了全新的思路。
然而,这类新发现并不是那么容易,所以每发现一个与疾病有关的特定微生物都显得弥足珍贵。近日,来自德国马克斯普朗克研究所和美国加州大学洛杉矶分校的两个研究团队,分别独立发现了促进多发性硬化发展的特定菌株[1]。多家科技媒体表示,「酸奶又可以多治一种疾病了」。当然,这是一句玩笑话,不过这也说明,一部分多发性硬化的治疗可能变得简单了。
多发性硬化是一种影响中枢神经系统的自身免疫性疾病,全世界范围内有250万人在遭受疾病的困扰,亚洲地区发病率约为十万分之五。在患者体内,神经纤维外面的保护壳——髓鞘被免疫系统“错认”为病原体而遭到攻击,受损乃至脱落。神经纤维失去了保护,神经信号不能正确传导,这就导致了一系列病症。患者们表现出肌无力,大小便失禁,记忆力下降,听力、吞咽和咀嚼功能逐渐丧失等症状,最终可能导致残疾。

上:正常神经纤维以及外侧包裹的髓鞘
下:多发性硬化患者的神经纤维,髓鞘受损,神经纤维暴露在外
至于病因,研究者们普遍认为,多发性硬化的发病是由基因和环境共同影响的。这也就是说,多发性硬化高危人群本身就是有一些基因缺陷的,这会让免疫系统错误地把髓鞘认成敌人,在受到某些特殊的环境影响,比如吸烟、减少光照、病毒感染[2]之后,免疫系统受到刺激失衡,他们就会发病。
肠道微生物和免疫系统的关系就不用奇点糕多说了,这些数以万亿计的“看不见的客人”参与维持免疫系统的正常功能,一旦菌群组成发生了改变,稳态被打破,免疫系统就很可能出现异常,引发自身免疫反应[3]。然而,每种自身免疫疾病对应的具体菌株,研究人员目前还知之甚少。

菌群结构稳定,促进炎症的免疫细胞(辅助T细胞,Th)和抑制炎症的免疫细胞(调节T细胞,Treg)的比例平衡(A),体内免疫水平正常,人体就保持健康。促进炎症的菌种增加(B)或抑制炎症的菌种减少(C),Treg和Th数量失衡,导致了发病[3]。
为了更了解多发性硬化,研究者们建立了一种具有基因缺陷的动物模型,称为实验性自身免疫性脑脊髓炎模型(EAE),EAE动物会自发地发展出与多发性硬化类似的症状,目前被认为是多发性硬化最理想的动物模型。值得一说的是,EAE小鼠在无菌环境下培养是不会发病的,但一旦给它们接种了粪便样本,即使当中不含病原体,它们也很快就会发展出多发性硬化症状[4]。这也一定程度上说明肠道微生物和多发性硬化发病有关。
这次,加州大学的研究者比对了71对健康人和多发性硬化患者,筛选到了三种具体的细菌——多发性硬化患者粪便中,醋酸钙不动杆菌(Acinetobater calcoaceticus)和嗜黏蛋白阿克曼氏菌(Akkermansia muciniphila)两种细菌的数量有明显上升,吉氏副拟杆菌(Parabacteroids distasonis)则有所下降。(以下为了描述简便,统称为不动杆菌、阿克曼氏菌和副拟杆菌)
当与健康人的免疫细胞共培养,这三种菌都分别表现出了对免疫细胞分化的影响。不动杆菌能减少调节T细胞(Treg)的分化,增加辅助T细胞1(Th1)的分化;而阿克曼氏菌增加Th1分化的作用更加明显;副拟杆菌则能够显著增加Treg的分化。
正常情况下,免疫系统内Th1激活免疫反应,Treg抑制免疫反应,二者平衡保持免疫系统的正常机能。在多发性硬化患者中,不动杆菌和阿克曼氏菌的升高带来了Th1细胞的增加,副拟杆菌的降低则让Treg细胞减少。天枰向Th细胞倾斜,免疫系统过分活跃,自身免疫反应也就随之而来。
把这三种菌移植给健康的小鼠,研究者们也观察到了它们对免疫细胞分化的影响。不过小鼠毕竟和人类还是有区别,阿克曼氏菌的作用并不像在细胞实验中那样明显。
当研究人员直接将多发性硬化患者的粪便移植给模拟多发性硬化的小鼠后,与移植了健康人粪便和无菌小鼠粪便的对照组相比,实验组的表现出的病症明显更严重。这也直接说明了,肠道微生物是推动多发性硬化发展的因素。
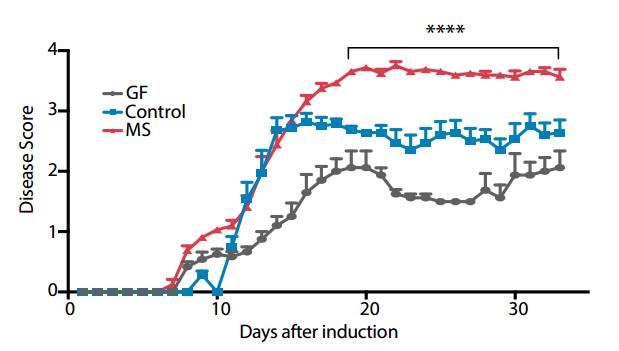
红色为移植了MS患者粪便的小鼠,蓝色为健康人粪便对照组,灰色为无菌小鼠粪便对照组。可见实验组疾病症状的评价分数远高于两个对照组
不过大家也知道,光是单个菌种的发现可能没太大说服力,毕竟肠道微生物那么复杂,构成上稍稍的一点差异或许就会带来不同的结果。而肠道微生物的构成又受遗传[5]、生活方式[6]等因素的影响,宿主的年纪、接受过的治疗、神经系统的情况[7]都是可能的变数。
为了尽量排除这种差异带来的影响,德国马克斯·普朗克研究所的研究者挑选了34对同卵双胞胎,每对双胞胎都是一人患病一人健康。他们基因型相对相似、生长环境又一样,那么他们之间的肠道微生物差异可能就是患病的关键。
前一项研究的成果在此得到了印证。多发性硬化患者的粪便样本中,阿克曼氏菌有明显升高。当给模型小鼠移植了粪便样本,12周后,它们的发病率几乎是对照组的三倍,并且在它们体内检测到了明显的白细胞介素(IL-10)的降低。IL-10是一种细胞因子,能抑制Th1细胞应答,是目前公认的炎症与免疫抑制因子。也有研究显示,多发性硬化患者体内IL-10水平的升高能缓解疾病症状[8]。

黄色为移植了多发性硬化患者粪便样本的小鼠的发病率
黑色为移植了健康双胞胎粪便样本的小鼠的发病率
这次科学家们找到了与多发性硬化相关的具体肠道菌种,探究了每种细菌对免疫细胞的具体影响,更难得的是两个团队不同角度的研究可以相互印证,这无疑给相关领域的专家们打了一针强心剂。来自东华盛顿大学的免疫学教授Javier Ochoa-Reparaz评论,这两项研究提供了“令人兴奋的新证据”,证实了一些肠道微生物会抑制关键的抗炎分子,与其他的遗传、环境因素共同触发多发性硬化[1]。
不过这两项研究都还存在着一些共通的问题:首先,两项研究的样本量都比较小;其次,粪便样本中的微生物群体不一定能够完全代表肠道微生物;再次,小鼠的免疫反应也与人类的不尽相同。两项研究的作者也表示,目前还需要更多的研究,来找到影响免疫细胞的具体分子机制。
从1993年第一个多发性硬化药物上市至今,FDA已经批准了14种药物,但它们大多造价高昂。今年3月刚获批的B细胞靶向药Ocrevus每年的治疗费用高达65000美元,这对于很多家庭来说都是难以承受的。奇点糕想,鉴于一些肠道微生物治疗已经开展的如火如荼,那么如果拿到了肠道微生物是推动多发性硬化发生发展的“实锤”,或许科学家们就能够在这方面做一些文章,为患者带来新的治疗希望。