胡善联,复旦大学公共卫生学院卫生经济学教授(退休),博士生导师。现任“沪苏浙皖闽”四省一市综合医改联席会议专家指导组副组长、中国社会保障学会医疗保障专业委员会常务委员、中国卫生经济学会卫生技术评估专业委员会副主任委员、中国中药协会药物经济学专业委员会顾问、中国研究型医院学会药物经济学专业委员会顾问、 中国药科大学国家药物政策与医药产业经济研究中心研究员、上海创奇健康发展研究院名誉院长。曾被表彰为有突出贡献的中青年科学家,享受国务院特殊津贴,并曾获国家科技进步三等奖,卫生部科技进步一等奖、三等奖,上海市五一劳动集体奖,上海市科学技术二等奖和中华医学科技奖卫生政策个人奖等多种荣誉。
摘要:当前,在罕见病药物发展中,有诸多问题面临着挑战。本文通过介绍罕见病治疗的伦理基础、孤儿药经济学研究的特殊性、孤儿药报销对医保基金的风险、平衡孤儿药的可及性和费用控制的国际经验,以及中国香港特区颁布的罕见病药物目录和中国罕见病药物医保现状,基于中国已公布罕见病目录和临床急需进口的抗肿瘤和孤儿药物现状,以及国际对于罕见病高价药物控费的经验,探讨了其对未来医疗保险可能带来的影响。从不同角度分析美国孤儿药法案、英国国家卫生和临床技术优化研究所高特技术新概念、爱尔兰国家药物经济学中心对不含抗肿瘤孤儿药药物经济学回顾性评阅、瑞典药物评估中心对孤儿药评价原则、土耳其对进口罕见病药物的专题研究、韩国对高价药费用控制的4种措施等实践经验,以期为中国罕见病药物政策的制定以及相关药物经济学发展提供借鉴。
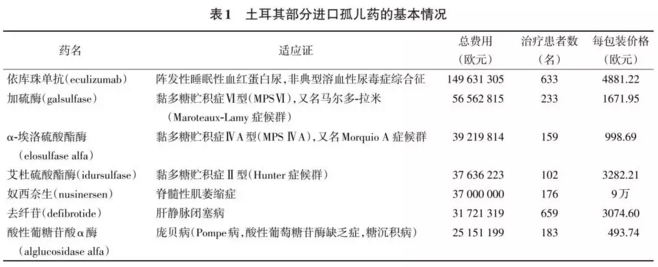
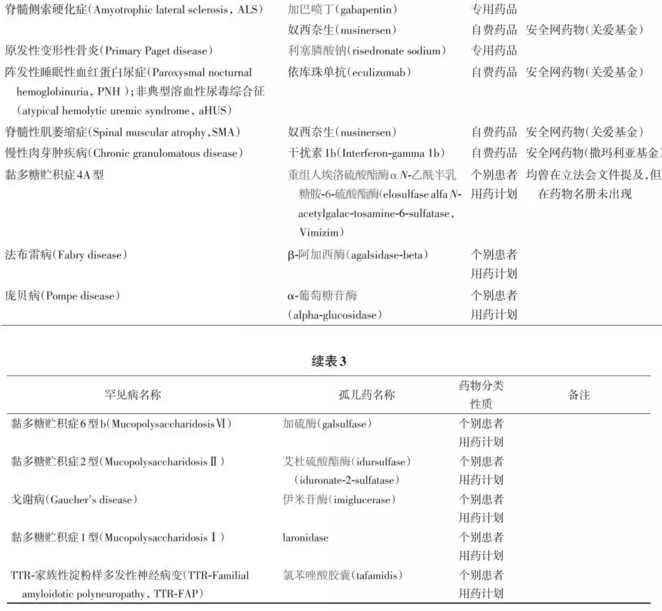
罕见病(rare disease)是一类发病率和患病率极低的疾病,其定义各国有不同,全球估计有近7000种罕见病,3.5亿罕见病患者[1],半数以上是由遗传引起的。如是由于基因突变或缺乏某种特殊酶所致,则需要终生的替代疗法,所以治疗费用极其昂贵。美国孤儿药(orphan drug)的定价平均为非孤儿药定价的6~7 倍;如不给予药物治疗则无法维持生命。治疗罕见病的药物可被认定为孤儿药。对那些患病率极低的超罕见病(ultra-rare disease)的治疗药物称之为超孤儿药(ultra-orphan drug)[2]。 当前罕见病诊治在诸多方面面临着挑战,如治疗的价值、生命终末期的治疗、精准医疗、基因和细胞治疗、孤儿药产品(orphan medicinal products, OMP)、超罕见病治疗、高度专业化(高特,highly specialized technologies)技术、抗肿瘤药和罕见病药物的定价问题等。 中国现有的医疗保险是一种普惠性质的、主要针对非罕见病的基本医疗保险制度,罕见病的对症疗法费用大都可报销,但还不能满足针对罕见病的孤儿药治疗的需求。中国发布第一批121种罕见病目录的目的是结合中国国情提出一批优先重点关注的、可防可治的罕见疾病,通过对国内市场已有的或临床急需国外进口的罕见病治疗药物减免进口关税和增值税,满足部分罕见病患者的用药需求。但这些治疗罕见病的药物如进入医保目录报销,对总的医保基金会带来多少影响?如何使这些孤儿药的价格能降低到社会保险、患者个人和家庭能承受的范围?有哪些国际的经验值得借鉴?本文就上述问题进行探讨。
1 罕见病治疗的伦理基础 罕见病患者和非罕见病患者一样都拥有生存权和健康权。按照世界卫生组织的公平性定义:“不同群体之间不存在可避免的、不公平的、或可补救的差异,无论这些群体是社会、经济、人口或地理上定义的,还是通过其他分层方式。‘健康公平’意味着,在理想情况下每个人都应有公平的机会实现其充分的健康潜力,任何人都不应因实现这一潜力而处于不利地位”。健康公平性是人类发展和社会公正的基本原则。如何取得较高水平的公平性是各国政府应考虑和承诺的问题。 目前由于孤儿药价格昂贵,1名罕见病患者每年的治疗费用动辄几百万,相当于成百上千的其他慢性病患者治疗费用的总和,因此就会产生是否“物有所值”的想法。如仅仅从经济学“性价比”的角度来评价是不够全面的,因为单纯的成本-效果分析(cost-effectiveness analysis,CEA)阈值不能反映孤儿药的治疗价值。对于罕见病的治疗首先需要从政治、社会、伦理角度来考虑,对孤儿药的卫生技术评估(health technology assessment,HTA)需要采用社会成本价值的分析(social cost value analysis, SCVA)[3]和社会意愿支付(social willingness to payment)的方法,包括平均的边际意愿支付或相对社会意愿支付(relative social willingness-to-payment)来测量相对的社会偏好(social preference)[4-5]。 2 孤儿药药物经济学研究的特殊性 孤儿药的药物经济学研究有很大的特殊性。首先,由于发病人数少,很难对孤儿药进行传统的随机对照双盲试验来测试临床疗效,以及采用比较成本效果的经济学分析方法开展药物经济学研究。因此,通常允许只做单臂试验,将历史的治疗情况作为默认的对照;或孤儿药上市后进行真实世界的研究,观察实际的临床效果。其次,由于孤儿药一般由制药企业自主定价,研发成本高,专利期长,导致孤儿药定价畸高,难以满足用传统的增量成本-效果比(the incremental cost-effectiveness ratio,ICER)或生命质量调整年(quality-adjusted life year,QALY)的阈值标准来评价。 为此,2013年英国国家卫生和临床优化研究所(National Institute of Health and Clinical Excellence,NICE)提出了高特技术的新概念。也就是说有很多创新的治疗方法或创新药物的经济学评价(包括孤儿药)已超越了传统的评价标准。按英国NICE 的定义,高特技术是指能治疗慢性和严重失能状况的少数病例的技术方法。病例组需要符合下列条件:①极少数中心能够治疗的少数病例;②具有特殊的临床原因。所谓“治疗慢性和严重失能状况”的情况是指专门用于如下方向:①非常特殊的服务环境;②通常需要很高的购买费用;③可能需要终生使用;④这项技术需要国家来决定能否报销。2017年4月以前,NICE 提出的只是高特技术的定性标准,如疾病的严重情况、未满足的需要、临床效益等;2017 年4月以后,NICE 提出了一些定量的评价标准:①病情性质;②临床效果;③货币价值,即允许每QALY>10万英镑;④如>10个QALY,则需给予附加的QALY权重;⑤技术的影响已超出了直接的健康效益[6]。 在NICE 网站上可查阅到2013~2018年有关高特技术的信息,包括ICER、获得的增量QALY值,以及权重和建议。迄今已有8项高特技术提出了最后建议,有6项提出了建议初稿,有5项正在研究中[7]。 英国超孤儿药治疗的超罕见病一般是指患病率<1/5万的疾病。由于超孤儿药的价格很高难以取得补偿,从2013 年起,英国NICE用高特技术的评价标准来对待超孤儿药。他们比较了2013年1月~2018年11月期间16种孤儿药的评价结果,发现各国对孤儿药的推荐情况是不一致的。因此,建议今后孤儿药生产企业在提交审批材料时要补充经济学评价的资料,包括ICER值。收集了8个超孤儿药的价格信息,包括非典型性溶血性尿毒症、淀粉样变性、低磷酸脂酶症、法布雷病、戈谢病Ⅰ型、血友病A、黏多糖贮积症和脊髓性肌萎缩症Ⅰ型。这8种疾病在美国的患病人数约为900~5400名。而这些超孤儿药与标准疗法比较能取得的增量QALY值为0.98~25.22,而10 年的药品成本大约在240万~510万美元。一个增量QALY估计为63 723 美元,根据回归曲线估计为400万美元。高特技术的评价方法是否对超孤儿药是最好的模式还有待于进一步研究。 就孤儿药来说,企业一般均有自主定价权,由于孤儿药市场需求相对较小,唯有较高的定价才能取得足够的投资回报。美国《孤儿药法案》给予孤儿药企业很大的自主定价权,全球最贵的药物中,几乎都是孤儿药。2018 年全球销售前10名的药品中有8种在美国获得孤儿药身份认定,其中4种是以孤儿药身份上市并逐渐扩展到多个罕见病或非罕见病适应证。如1997年利妥昔单抗获批用于治疗非霍奇金淋巴瘤,随后扩展了多种适应证;来那度胺在美国获批的所有适应证都是罕见病,且获得了孤儿药身份认定。治疗罕见病遗传性视网膜营养不良的基因药物伏瑞替金尼酯(voretigene neparvovec,Luxtur)能一次性治愈遗传性儿童致盲病症,其定价是每剂276万美元。目前世界上最贵的孤儿药还有阿利帕金替酯(alipogene tiparvovec,Glybera),该药是由AMT 制药公司研制用于治疗家族性脂蛋白脂肪酶缺乏症的基因药物,该药每剂费用>120万美元。另外,依库珠单抗(eculizumab,Soliris)注射剂用于治疗阵发性睡眠性血红蛋白尿(paroxysmal nocturnal hemoglobinuria,PNH)和非典型溶血性尿毒症综合征(atypical hemolytic uremic syndrome,aHUS),每年花费>50万美元。Evaluate Pharma 公司统计显示,2016 年罕见病患者平均医疗投入为每人14.04 万美元/年。经典的超罕见病极为罕见,如在美国,超罕见病指患者人数<1万名的疾病,在欧盟为患病率<1/5万的疾病。超罕见病缺乏有效的诊断和及时的治疗,特别是在孤儿药发展的早期阶段,此时的商业模式是鉴别罕见病患者,通过接触罕见病患者组织的机会让企业介入,同时鼓励研发,给予孤儿药高定价。如健赞公司从20世纪80 年代发起对戈谢病的关注,提高医师和患者群体对该病的认知率,为孤儿药的市场提供了坚实的基础。 在孤儿药和超孤儿药的药物经济学成本-效果评价中,爱尔兰国家药物经济学中心(National Centre for Pharmacoeconomics, NCPE)卫生技术评估机构曾对2015~2017年不包含抗肿瘤药物的孤儿药进行了药物经济学回顾性评估。评价的原则有3条:①成本-效果的阈值;②获得权重的QALY值;③社会的观点(societal perspective)。3年来NCPE共测定了64种孤儿药和非孤儿药,其中21种(33%)是孤儿药。非抗肿瘤的孤儿药物为14种(占22%)。14种孤儿药中均无QALY值为<4.5万欧元的,只有1种孤儿药的QALY值<10万欧元,其他12种孤儿药QALY阈值均>15万欧元。14种孤儿药中有13种其增量QALY<10,所以应用的权重值(weighted QALY gain)为1。在探索社会观点方面,在14种孤儿药的药企提交的审批文件中有6种(43%)提到了用社会观点来评价。总之,药物经济学的评价能支持对孤儿药的决策。 瑞典的药品署药品管制和监控药品评估中心(Lkemedelsverket,TLV)对孤儿药的评价原则有3条:①人类尊严的原则(human dignity principle)、②需要互助的原则(needs-solidarity principle)、③接受高度的临床不确定性(higher degree of clinical uncertainty accepted)的原则。法国国家卫生管理局HTA评估机构(Haute Antoritede Sante,HAS)的评价原则也是3条;①预算原则,即每年不超过3000万欧元,②没有满足的需要(unmet needs),③要考虑罕见病是否危及生命。 英国NICE提出了如何加强患者接受超孤儿药的能力,作为公共参与项目(public involvement programme)。NICE从2013年开始评价超孤儿药,认为这是属于高特技术的一种,已发表了9篇超孤儿药的评价指南。有10种超孤儿药正在进行评价之中。患者组织也参与工作,从患者方面提供治疗后的影响情况;反之,评价结果也反馈到患者组织中去。通过患者组织的调查,认为QALY测量并不能全面反映患者的整体效益,对临床疗效方面还可给于一个相对的影响,如可提供对疼痛的反应和返回工作的情况、对患者和家庭的焦虑、症状的改善、提供改善生活质量和日常活动的能力。对评价QALY和ICER值也有很大的帮助,因为患者的反映可提供更多的循证依据。 3 孤儿药进入医保报销目录对医保基金的风险 孤儿药进入医疗保险药品报销目录会带来对医保基金的冲击,这是毋庸置疑的,但其影响度有多大,取决于医保基金的预算、纳入罕见病的数量、治疗人数和孤儿药的品种和价格,还需要通过实践应用和进一步的调查研究来证实。 近年来中国提出了需要进口孤儿药的清单。土耳其曾专门对国外进口的罕见病药物(medicines bringing from abroad, MBFA)的数量、单位和费用进行过专题研究(表1),这方面的经验是值得借鉴的。土耳其相关部门研究发现,罕见病的药物市场中未上市或者未审批的药物使用的费用接近药品总费用的8%。其中80%药费是由前10位价格昂贵的进口药所导致。2017年统计42种孤儿药费用为4.55亿美元, 占进口药物费用的83%。在最贵的10种药中有7种是孤儿药。如治疗PNH患者的伊库珠单抗总预算为1.5亿美元(占进口药品费用的27%和总药品费用的2%)[8]。 4 探索孤儿药可及性和费用控制的平衡手段 韩国对高价药费用的控制采用4种措施[9-10]:①有条件性治疗+费用返还(conditional treatment continuation plus refund)。这是一种基于临床治疗健康结果的绩效评价,如果未达到临床治疗预期阈值则返还药费;②最大的预算封顶(maximum budget cap)。其特点是以财政为基础,如将抗肿瘤药物和罕见病药物达到的期望销量(expected volume)130%设为封顶线。对豁免CEA测定的药物或等效性的药物则以100%预期销量为封顶线;③费用返还(refund)。以财政为基础,按合同治疗人数报销,超出的费用部分返还;④对每名患者设立报销封顶(per patient cap),按人头支付根据合同预先设定的治疗患者的数量和药品销售量,如超过患者的数量须将费用返还。 风险分担合同(risk-sharing agreement, RSA)也是解决高价药物可及性的一种方法。如最大的预算封顶类型和费用返还类型已在很多国家使用,能有效地控制医保的预算。在韩国,药品价格(maximum allowance price)是在网上公布的,由于参照韩国药品价格的国家日益增多,这对韩国患者接受创新药物带来负面的影响。RSA有利于设立国际参考价格。另外一种风险分担合同的方式如利那度胺(lenalidomide)在治疗多发性骨髓瘤时,韩国医疗保险首先支付10个周期,每个周期为21~28 d,以后由药企支付所有其余的治疗周期。 新加坡则采用3项措施来控制高新药物(包括孤儿药)的报销。首先是通过常规的药物类别的评审,如新加坡对直接抗丙型肝炎的药物进行了系统研究,通过Markov模型评价临床结果和对经济的影响,从价值定价角度去改善临床疗效。通过明显降低药物价格,提高患者对药物的可及性,避免肝病进展到晚期肝硬变、肝癌及死亡,为卫生系统减少了开支。其次是评价新生物类似药替代原研生物药。新加坡还在药物使用上通过临床指南、医生和患者的教育,帮助做出用药的适宜选择。如通过选用较为便宜的,在药品报销目录中的英夫利昔单抗(infliximab)生物类似药Remsima来替代原研药(Remicade)。又如用4种批准的生物类似药来代替每年消费2600万美元的曲妥珠单抗(赫赛汀,trastuzumab);已有2种生物类似物药品可用于取代利妥昔单抗(rituximab),每年可减少1200万美元支出。阿达木单抗(adalimumab)每年消费达500万美元,可选用5种生物类似物药品来代替。患者用生物类似物药品治疗一般要比参考生物制剂的价格便宜30%~50%,可为卫生系统节省费用。政府机构与药企谈判利用药物经济学研究结果作为能否列入药品报销目录的手段(表2)。第3项措施是转向应用最有成本-效果的治疗方法。新加坡将应用卫生技术评估方法与以价值为基础的定价方法去管理高价的药物,确保长期的可持续性。将运用国际风险分担合同方法结合新加坡的实际卫生筹资情况,最终是需要找到价值和患者能及时获得这些药物之间的平衡。 马来西亚从2001年后开始对专利药和非专利药开展价格谈判。以曲妥珠单抗(440 mg)注射剂为例,药价下降了52%,增加了患者的可及性。药品采购中注意了成本、质量和配送,价格谈判中注意价值和价格[9-10]。 5 中国罕见病药物目录及现状 5. 1 中国香港颁布罕见病药物目录 中国香港特别行政区2019年3月公布了罕见病药物目录(表3)。此次颁布的罕见病药物清单,包括通用药物、专用药物、自费药物和个别患者用药等4种用药计划。通用药是其他疾病或症状均可使用的药物;专用药物是针对罕见病的用药;自费药是需要患者自费负担的,但可有慈善基金的资助;个别患者用药则是指部分超罕见病患者的个别用药。 5. 2 中国内地部分孤儿药纳入基本医疗保险 20世纪80年代,上海在全国率先全覆盖开展苯丙酮尿症新生儿筛查。2007年又对先天性肾上腺皮质增生症和葡萄糖6-磷酸脱氢酶缺乏症进行全覆盖筛查。对治疗戈谢病的药(伊米苷酶)虽未纳入医保报销范围,但通过市少儿住院互助基金、市慈善基金会,对0~18岁苯丙酮尿症患儿每月补助500元,用于购买特殊奶粉。2011年将一些罕见病特殊治疗药物纳入少儿住院基金支付范围,如戈谢病、法布雷病、庞贝病和黏多糖贮积症等4种罕见病补助,罕见病儿童每年给予不超过20万元的救助。曾呼吁单独设立罕见病医保用药目录。 青岛市罕见病医疗保障起源于门诊大病政策。2005年,青岛市城镇居民医保将白塞病、多发性硬化和重症肌无力3种罕见病纳入门诊大病;2012年,又将肢端肥大症、原发性肺动脉高压和BH4缺乏症3种罕见病纳入基本医疗保险门诊特殊疾病管理;2014年正式实施大病医疗救助制度,将罕见病纳入大病医疗救助范围;2016年三保合一后,该市开始实施全民补充医疗保险,将特药(主要是罕见病用药)特材纳入补充医疗保险。以戈谢病为例,医保筹资模式包括民政救助、医疗保险基金和社会资金。医保报销80%;剩余的20%若>5万元,医保再报销其中的70%,但一年内不超过20万。其后山东、浙江两省相继在罕见病防治方面均做出了重大的贡献。 中国内地已公布了第一批罕见病目录,121种疾病中已有53种罕见病的83种药品获批上市,目前有18种罕见病的29种药品被纳入基本医疗保险报销。但目前仍未能满足患者的需求,孤儿药的年治疗费用极其昂贵,给患者及其家庭带来了灾难性的支出。希望在2019年修订医疗保险药品目录的基础上,今后可明确用于治疗罕见病药品的清单,并从中进行分类,用于指导未来采用不同的支付方式。 致谢 香港中文大学药学院Vivian Lee 教授为本文提供中国香港特别行政区于2019年3月公布的罕见病药物目录,特此感谢! 原文刊载:《国际药学研究杂志》2019,46(9)652-658页