
基因疗法与传统药物治疗模式不同,通过单次或少数几次治疗一次性的解决患者的疾病问题,无需患者长期用药。基因疗法针对癌症或者罕见病等重大疾病领域,通过较为短暂的治疗期间提供长期的临床疗效,其定价和准入模式也和传统的药物存在较大的差异。例如已经在我国上市的治疗脊髓性肌萎缩症的诺西那生钠注射液,就是一种基因疗法,但目前定价十分昂贵,因此也没有能进入到我国2020年的国家医保谈判中。未来我国将上市更多的基因疗法,本文将介绍全球的基因疗法市场以及相应的准入情况,以期借鉴作用。
基因治疗的概述
美国食品药品监督管理局(FDA)对基因疗法的定义是“通过修复一个人的基因来治疗或治愈疾病的技术”,基因疗法可能通过多种机制发挥作用:
(1)用一个健康的基因拷贝来替换致病基因;
(2)恰当地灭活一个不起作用的致病基因;
(3)向体内引入一个新的或改造的基因以辅助治疗一种疾病。
同时,食品药品监督管理局(FDA)定义人类基因疗法应该调整或控制基因的表达或者为了治疗目的改变活细胞的生物学特点。作为健康科学和药学领域的一次革命,基因治疗药物是基因治疗临床实践中药物监管部门批准的用于治疗、预防或诊断的药学产品。基因治疗药物也是为了治疗、预防或诊断的目的,以核酸、脂质复合物、病毒或基因工程微型有机体的形式应用的生物医学产品。在四川大学华西医院魏于全院士团队的文章中,世界范围内被批准的质粒DNA、反义寡核苷酸、小干扰RNA-脂质复合体、病毒以及遗传工程细胞治疗产品都被列为基因治疗药物。
医麦客团队整理了基因治疗的分类,清晰易懂。首先将基因治疗分为基于DNA和基于RNA两大类,再进行细分。详情见下图。
图:基因治疗的分类
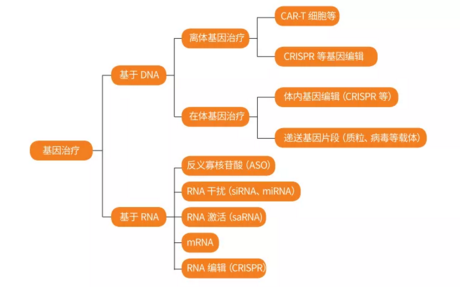
近年来,随着基因治疗领域中多项技术的迅猛发展,基因治疗已在多种适应症中大放异彩,进入临床开发或上市的药物适应症包括单基因遗传病、血友病、眼科疾病、部分神经退行性疾病、发病/治疗机制相对明确的多基因遗传病以及癌症的治疗方面等。相比于其他药物,基因治疗的优势在于从根本解决问题,有望通过一次性方式治疗疾病。
根据市场调研机构Fortune Business Insights发布的报告,2019年基因治疗市场规模为36.1亿美元,预计到2027年将达到356.7亿美元,预测期内的年均复合增长率(CAGR)为33.6%。
近年国际上获批的基因治疗药物
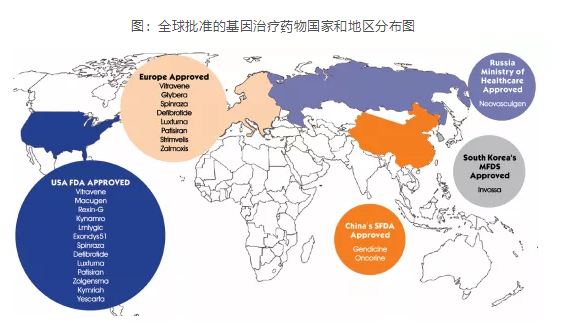
全球已有20多个基因治疗产品上市(其中2个产品目前已撤市),产品类型涉及寡核苷酸类、溶瘤病毒、CAR-T疗法、干细胞疗法以及其他基于细胞的基因疗法。外国学者Shahryari, A等总结了全球批准的基因治疗药物的国家和地区分布,以美国和欧盟为主,详情见下图。
图:全球批准的基因治疗药物国家和地区分布图
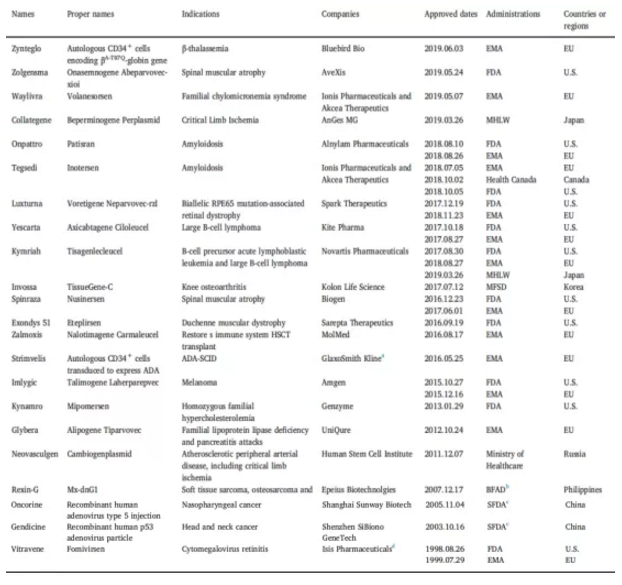
中国学者Ma cui-cui等总结了20多个基因药物的名称、适应症、开发的机构、批准的日期及机构,以及获批的国家和地区情况。详情请见下表。
表:全球获批的基因治疗产品基本信息
下面列出近年来欧盟EMA和美国FDA批准的多款罕见病基因治疗产品:
2016年5月,EMA批准了GSK公司的Strimvelis上市,用于治疗腺苷酸脱氢酶(ADA)缺失导致的严重联合免疫缺陷(SCID)。ADA-SCID由于免疫系统严重受损,部分患者在婴幼儿时期死亡,其他的患者只能终生生活在无菌环境中,又被称为“泡泡男孩病”。在该疗法出现之前,患者只能依靠干细胞移植或酶替代疗法控制,酶替代疗法需要每周注射,每年价格40万美元左右。Strimvelis是一种体外基因疗法,使用γ-逆转录病毒将正常ADA基因导入患者CD34+ HSPCs中,理论上仅需一次治疗即可终生获益。该疗法的价格大约在66万美元一次。
2016年12月,FDA的批准了Biogen的基因疗法Spinraza(nusinersen)的上市,是全球首个用于治疗脊髓性肌萎缩症(SMA)的精准靶向治疗药物。2019年7月,在长达四年的治疗过程中,Biogen公布了其突破性成果,100%接受该药物治疗的孩子都可以坐直,88%的患者在没有帮助的情况下独立行走。Spinraza目前已在40多个国家销售,中国也于2019年2月底批准。Spinraza是一种经修饰的反义核苷酸(ASO),通过与SMN2外显子7的剪切位点结合,降低药物在剪接中被截断的机会,增加全长SMN蛋白的产生和数量,从而治疗疾病。Spinraza需要通过腰穿鞘内注射,每4个月一次。理论上可能需要终生注射,相对应的治疗价格为第一年75万美元,此后每年37.5万美元。
2017年12月,FDA批准了Spark Therapeutics公司开发的Luxturna,用于治疗RPE65双等位基因突变导致的遗传性视网膜疾病先天性黑朦症II型(Leber’s congenital amaurosis, LCA)。RPE65基因突变导致其蛋白失去异构酶活性,引起11-顺-视黄醛缺乏,从而造成光感受器细胞无法感光,疾病晚期则发生视锥细胞和视杆细胞变性,发生严重的视力丧失。在Luxturna获批上市前,LCA尚无有效治疗药物。Luxturna使用AAV2携带RPE65基因,在视网膜下腔直接注射的方法将病毒导入眼球中。该疗法的价格为双眼85万美元左右。
2019年5月,FDA批准了诺华公司旗下AveXi的体内基因治疗药物Zolgensma,用于治疗SMN1双等位基因缺陷的脊髓型肌肉萎缩(SMA)婴儿患者(<2岁)。Zolgensma通过静脉输注AAV9载体携带的SMN功能基因,实现对于SMA的根治,官方定价为212.5万美金一次治疗,为史上单次治疗最贵药物。
2019年6月,EMA对蓝鸟生物开发的药物Zynteglo进行了有条件批准,用于治疗12岁以上非β0/β0基因型输血依赖型β-地中海贫血(TDT)患者。Zynteglo为一种体外基因疗法,通过慢病毒载体将功能性人βA-T87Q-珠蛋白基因导入CD34+ HSC中并回输,使患者能自主生成β-珠蛋白,从而产生足够的血红蛋白,减少或消除输血治疗的必要性。此外,蓝鸟生物正在测试Zynteglo在镰刀型红细胞贫血中的疗效,计划2020年在美国进行销售。该疗法的180万美元一次治疗,是仅次于Zolgensma的“第二贵”药物。
基因治疗的支付困境及国际创新案例
基因治疗与可以大量制造和储存使用的大多数传统药物不同,药物本身在研发、制造工艺以及用药后对患者进行持续监测上的成本都决定了该疗法的价格在短期内仍保持在高位。因此如何支付这类价格高昂的药物,仍是一个难题。
基因治疗的适应症往往以罕见病为主,这些疾病的患病人群虽小,但基因治疗的研发过程却需要大量的资金投入。产品的定价要能够在专利到期之前覆盖成本,并为公司带来一定的收入。而在目标人群小的情况下,每个患者需要分摊的研发成本就要相应增高。没有相对高昂的定价,药企就无法推动这种药物的研发及上市。从根本上来说,基因疗法的定价远非普通家庭可以承担,这就需要考虑创新支付方案。
现阶段采取的方式包括支付方和药企共同协商,药企提出了分期付款、延长付款、按疗效付费等创新付费方式。德勤公司对近期全球细胞和基因治疗的支付政策进行了梳理,详见下表。从表中可知在细胞和基因疗法的支付政策上,美国以商业保险、公共医保基于疗效付款和患者自付的形式支付;意大利和英国由公共医保基于疗效和真实世界数据进行付款和报销;日本则有公共医保进行健康技术评估和患者自付的形式支付。
表:细胞和基因疗法支付政策一览

随着高效和潜在治愈性细胞和基因疗法的出现,我们正在进入医学的新时代,处于医学细胞和基因治疗革命的开端。基因治疗被认为是目前人类疾病中具有突破性疗效的治疗手段,有可能达到的“一次治疗、终生治愈”的潜在疗效。许多公司或机构也正在从研发和制造方面入手,研究开发成本低且安全有效的新一代基因治疗。今天的医疗保健系统大多数为需要长期支付的、针对慢性疾病的药物买单。然而细胞和基因疗法大多是一次性治疗,它们的开发、制造、分销和管理方式与之前的药物有着根本的不同,因此我们需要一种新的评估和支付模式。为了推动患者获取有效的基因治疗,企业需在临床试验阶段积累长期患者随访信息,以便与当地临床专家、患者倡议组织、健康经济学专家及政策研究专家尽早讨论起基因治疗产品的独特价值。同时探索创新支付模式,解决医保方面担心的治疗总费用高、前期支付负担重、临床效果不确定或患者纠纷风险等问题。罕见病基因疗法的未来支付方式,可能会从现有的按疗效收费、分期付款、医保付费发展为未来的多支付主体、多支付手段相结合的方式。
本文摘取自《中国Leber遗传性视神经病变患者生存状况调研报告》 ,该报告由蔻德罕见病中心(CORD,原罕见病发展中心)发布。本调研报告是国内首次针对LHON这一群体的较大规模患者调研,对中国各地LHON患者的生存现状、诊疗情况、心理负担和疾病负担进行了全面研究,同时也针对全球的LHON现有基因治疗及创新支付等情况做了初步分析。调研项目通过定量与定性相结合的方法,来自于我国28个省区和直辖市的539位患者通过问卷调查的形式参与了此次调研。定性方面,共10位参与了问卷调查的患者接受了电话访谈,另有5位LHON临床医学专家以及一位基础研究科学家参与了深度访谈。