2022年2月7月,基因治疗公司Sangamo Therapeutics宣布了 1/2 期 STAAR 临床研究的最新初步结果,该研究评估了使用基因治疗产品isaralgagene civaparvovec (ST-920)治疗法布里病的最新数据:截至2021年11月9 日,研究显示使用ST-920持续治疗具有良好的耐受性,并使四名治疗时间最长(52周)的患者体内的α-半乳糖苷酶 A (α-Gal A) 活性升高,说明了上述基因疗法具有改善法布里病的潜力。

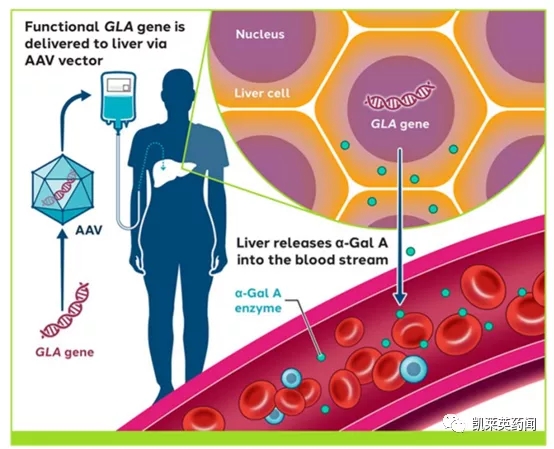
法布里病(Fabry disease)是一种罕见的X连锁遗传性疾病,由于X染色体长臂中段编码α-Gal A的基因突变,导致α-Gal A结构和功能异常,使其代谢底物三已糖神经酰胺(GL-3)和相关鞘糖脂在全身多个器官内大量堆积所导致的临床综合征。法布里病临床表现为多器官、多系统受累,男性重于女性患者。国外报道在男性新生儿中发病率为1/110 000-1/40000,国内尚无人群发病统计数据,另有报道在终末期肾脏病透析患者中的患病率为0.12%。目前,法布里病的标准治疗为酶替代疗法(ERT),然而它们不但见效较慢,无法解决大脑和神经系统中出现的症状,而且可能引发患者的免疫反应,导致疗效的下降。Sangamo Therapeutics的ST-920是一款一次性输注、肝脏靶向的基因疗法,它通过腺相关病毒载体(AAV)向患者肝脏递送功能性GLA基因拷贝,从而使细胞恢复生产AGA,有望为法布里病患者带来新曙光。
关于STAAR试验
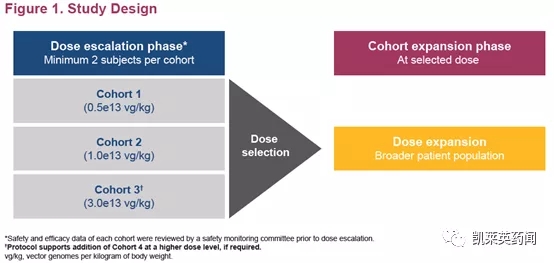
STAAR(ST-920-201)是一项 1/2 期剂量范围、单剂量、开放标签、多中心研究,旨在评估 ST-920 在患有法布里病的成人(≥18 岁)中的安全性和耐受性(NCT04046224)。将试验受试者分为三个组,包括第一组中的2名受试者(0.5e13 vg/kg),第二组中的2名受试者(1.0e13 vg/kg)和第三组中的 1 名受试者(3.0e13 vg/kg)。
结果显示,在接受前两个剂量组(0.5e13 vg/kg 和 1e13 vg/kg)治疗的四名患者中,α-Gal A 活性保持在高于平均正常值 3 倍至 15 倍的范围;在第三组中的1名患者(3e13 vg/kg)中,α-Gal A 活性在第 2 周已增加到平均正常范围。对于联合ERT治疗的两名患者,第 52 周的 α-Gal A 活性比正常平均值高 15 倍(第一组),第 25 周的 α-Gal A 活性比正常平均值高 10 倍(第二组)。对于两名未接受ERT的初治患者,第 52 周的α-Gal A 活性比平均正常值高 3 倍(第一组),在第 40 周的α-Gal A 活性比平均正常值高 4 倍(第二组)。

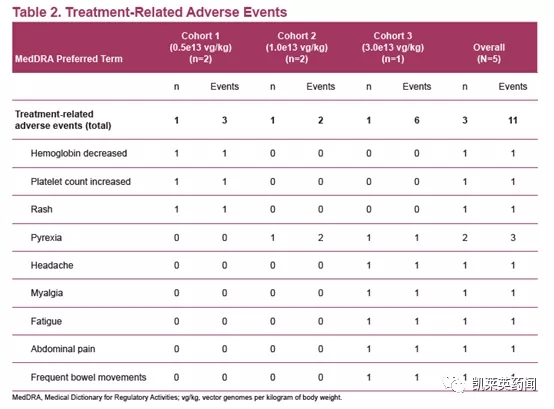
在安全性上,使用ST-920 的耐受性普遍良好。其中,3 名受试者发生了11 次与治疗相关的不良事件(AE),均为 1 级(轻度);治疗过程中未报告与治疗相关的严重 AE;没有需要类固醇治疗的肝酶升高。
关于SangamoTherapeutics
Sangamo是一家临床阶段的基因药物公司,总部位于美国加州里士满,于2000年上市。公司通过运用ZFN基因编辑技术等进行早期临床试验,还与辉瑞、赛诺菲、武田、渤健等制药公司合作执行后期临床试验和商业化发展,来开发不同方向的技术应用的产品。
Sangamo Therapeutics的研发管线
