血友病是遗传性凝血因子缺乏引起的出血性疾病,患者常自幼年发病、自发或轻度外伤后出血,在外伤、手术时常出血不止。根据缺乏的凝血因子不同,分为A型血友病(FⅧ缺乏)和B型血友病(FⅨ缺乏)。尽管目前有治疗方法,但血友病患者的治疗需求仍未得到满足。Concizumab作为一种新疗法,之前Shapiro等报道了两项 2 期concizumab 主要部分试验结果,现在他们展示了这些试验的扩展部分结果,评估concizumab的长期安全性和有效性。

目前血友病治疗指南推荐使用缺乏的凝血因子(A型血友病 [HA] 中的因子 VIII [FVIII] 和B型血友病 [HB] 中的因子 IX [FIX])进行替代治疗。然而,定期静脉输注是因子替代疗法的一个缺点,影响患者依从性,带来重大治疗负担。此外,抑制性抗体的产生导致因子替代疗法的疗效并不理想。大约 25%-30% 的重度 HA 患者和 1% -10% 的重度 HB 患者会产生抑制性抗体(HAwI、HBwI),导致输注的替代因子完全或部分失活,增加患者的疾病负担。
由于以上需求,需要开发非因子替代疗法。一种是使用非因子疗法来增强凝血或靶向抗凝血途径。已经研究了几种靶向凝血途径的单克隆抗体,包括 emicizumab和 BAY1093884,因为血栓栓塞事件 (TEs) 的发生,BAY1093884 的开发于 2019 年终止。
Concizumab 是一种抗组织因子途径抑制性抗体 (TFPI),经皮下注射用于预防所有血友病亚型,其作用独立于 FVIII 和 FIX,通过增加 FXa 的产生增强凝血起始阶段,从而产生足够的凝血酶 (TG) 以防止出血。之前两项试验表明:concizumab 具有良好的耐受性,且能提供预防性出血保护。
试验设计 explorer4 是一项开放标签、多中心、随机对照试验,患者以 2:1 的比例随机接受 concizumab 预防或 eptacog alfa (重组活化因子 VII [rFVIIa])的按需治疗。所有接受 rFVIIa 的患者在扩展部分(≥52 周)改用 concizumab 治疗。explorer5是一项开放标签、多中心、单臂试验,所有患者在主要和扩展部分接受 concizumab 的预防性治疗。患者每天接受 0.15 mg/kg 的 concizumab 皮下注射,潜在剂量增加至0.20 或 0.25 mg/kg(图 1)。explorer4 和 explorer5 试验均经伦理委员会审批,并向患者提供了书面知情同意书。纳入和排除的详细标准之前已报道。
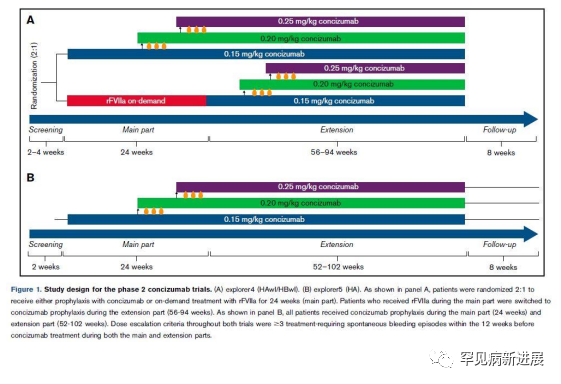
图1 两项concizumab试验研究设计
目标、终点和评估 explorer4 和 explorer5 试验旨在评估每日一次皮下注射 concizumab的疗效和安全性,包括在至少 76 周时间内治疗的有效性和安全性,并评估其免疫原性和患者报告结局。主要终点是治疗开始后至少 24 周内治疗出血事件次数。在试验扩展部分评估的次要疗效终点为至少 76 周治疗期间治疗出血事件次数和自发出血事件次数。次要药代动力学和药效学终点包括 concizumab 浓度、游离 TFPI 浓度、峰值 TG 和 TG 电位。次要安全终点包括出现的 AE 数量;抗药物抗体 (ADAs) 的出现;治疗期间D-二聚体浓度、凝血酶原片段 1+2 和其他凝血参数相对于基线的变化等。TE是AE特别重要的一方面。AE 还包括注射部位反应、超敏反应和用药错误。 统计分析 使用 SAS 9.4 版进行数据分析,试验扩展部分疗效结果显示为最后 concizumab 剂量水平,以及整个暴露期间的年化出血率 (ABR)。
试验人群和基线特征 explorer4试验中,随机分配26名患者,其中17名患者接受concizumab治疗,9名患者接受rFVIIa按需治疗。25 名患者完成主体部分并进入扩展部分(15 名 HAwI 患者和 10 名 HBwI 患者)(图 2)。32 名 HA 患者完成 explorer5 的主体部分并进入扩展部分,29 人完成了两个部分。两项试验的患者基线特征相似。
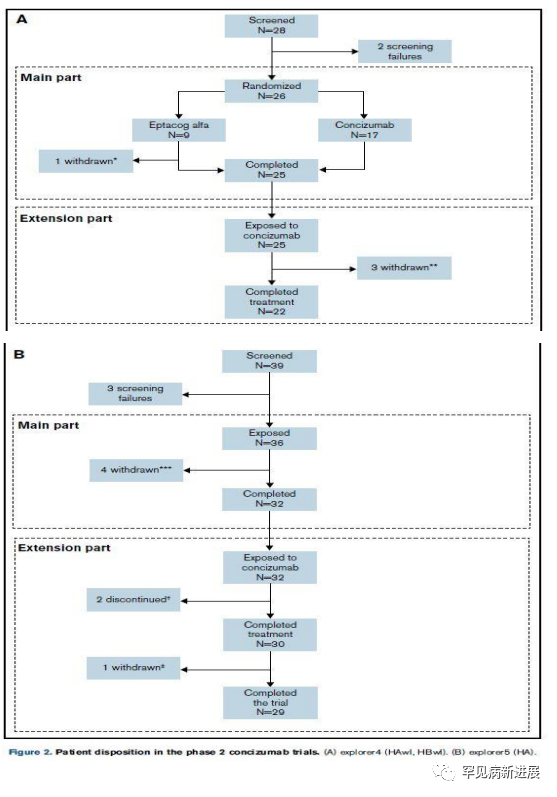
图2 两项2期concizumab试验患者的处置
explorer4 和 explorer5 试验的长期疗效 在 explorer4 的扩展部分,25 名患者中有 12 名继续接受 0.15 mg/kg剂量(7 名 HAwI , 5 名 HBwI ),6 名 HAwI和 3 名 HBwI 患者剂量升至 0.20 mg/kg,2 名 HAwI 和 2 名 HBwI 患者升至0.25 mg/kg。在 explorer5 试验中,15 名患者保持其原始剂量,10 名升至0.20 mg/kg, 11 名升至 0.25 mg/kg(表 1)。 表1 根据血友病亚型,在试验扩展部分 Concizumab 剂量递增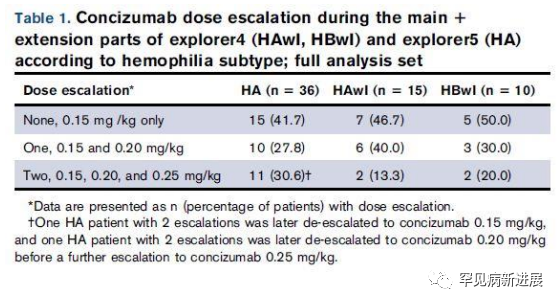
出血事件
在 explorer4 和 explorer5 中,扩展部分最后剂量水平估计的 ABR 分别为 4.8和 6.4。在 explorer4 中,估计的末次剂量水平 ABR 为 HAwI 3.8、HBwI 6.2 (图 3)。在 explorer 4 和 explorer5 中,末次剂量水平的估计自发 ABR 为 1.8和 2.1。在 explorer4 中,HAwI 患者的自发 ABR 为 1.6,HBwI 患者的自发 ABR 为 2.1。在 explorer4 和 explorer5联合 ABR 分别为3.2和5.3。
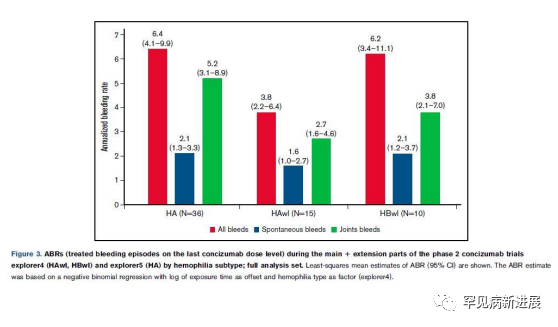
图3 在 2 期 concizumab 试验的扩展部分的ABR
在 explorer4 扩展部分从 rFVIIa 转换为 concizumab 的患者中,末次剂量水平估计的 ABR 从 18.6降至与总体人群中观察到的水平相当。同样,估计的平均自发ABR 从 16.9下降到 2.5,关节出血ARB从 13.8下降到 2.9。三名患者在最后一次 concizumab 剂量水平经历了零出血。
药代动力学和药效学
在 explorer4 和 explorer5 的扩展部分,有或无抑制性抗体的患者中观察到相似水平的 concizumab,游离 TFPI 水平随着 concizumab 浓度增加而降低(图 4A-B)。在两个试验中,在 concizumab 治疗 76 周的最后一次给药前,所有 3 个剂量水平的平均峰值 TG均在正常参考范围内(26-147 nmol/L),其他 TG 参数观察到类似趋势。
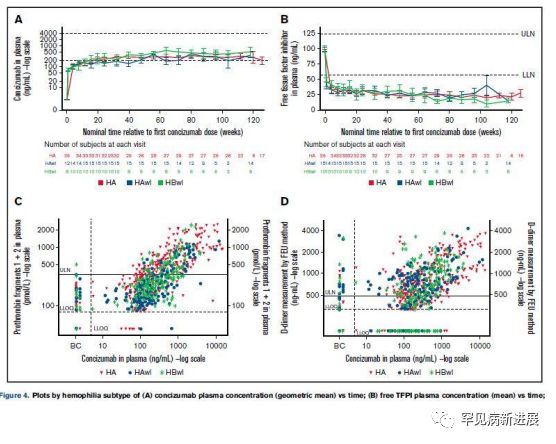
图4 两项实验的药代动力学和药效学结果
安全性
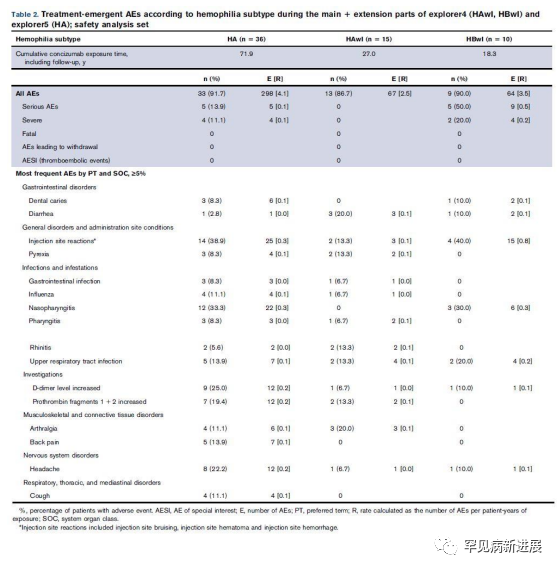
在 explorer4 和 explorer5 的扩展部分报告的大多数 AE 为轻度,没有死亡,也没有导致退出试验的事件(表 2)。两试验均未记录到TE。在 explorer4 的扩展部分,4 名 HBwI 患者报告了 15 次注射部位反应,2 名 HAwI 患者报告了 3 次,在 explorer5中14 名患者报告了 25 次注射部位反应。大多数为瘀伤、血肿或出血,多发生在0.15 mg/kg 剂量的患者中。
表2 在 explorer4和 explorer5的扩展部分期间出现的 AE
在 explorer4试验扩展部分未观察到抑制性抗体超敏反应。1 名患者报告了 3 起非严重的轻度超敏反应事件。该患者此前曾在接受其它药物治疗时出现类似症状,无需针对这些症状进行治疗。在所有 concizumab 剂量水平上观察到升高的 D-二聚体和凝血酶原片段,表明 concizumab 的止血作用(图 4C-D)。由 rFVIIa 切换到concizumab 治疗的患者安全性结果与整个研究人群中结果相似。
免疫原性
在 explorer4 和 explorer5 的扩展部分,分别有 6 名和 9 名患者出现了 Concizumab ADA,除了 explorer4 的 1 名患者外,其他患者没有明显的临床效应。explorer4 中 5 名患者ADA滴度较低,其中 3 名患者在试验过程中降至检测水平以下。在 explorer5 期间发生 ADA 的 9 名患者滴度也较低,其中 7 名患者在试验期间发生短暂 ADA,2 名在试验结束时发生 ADA。explorer4 的一名患者最初具有低滴度的 ADA,在经历严重创伤并暂时停止 concizumab 治疗后,发展为高滴度ADA。
Concizumab 的疗效维持较好,更多患者在两项试验的扩展部分增加剂量。在至少 76 周治疗后最后一次 concizumab 剂量水平估计的ABR 与主要部分中观察到的相当。接受 rFVIIa 的患者改用 concizumab 时,ABR 显著降低,比率为 0.26。explorer4 试验包括 10 名 HBwI 患者,代表了一个脆弱的患者群体,其治疗需求水平特别高。这一报告的结果对这个群体特别重要。
扩展部分的结果表明:concizumab 预防通常具有良好的耐受性,没有导致退出、TE 或死亡的 AE。接受 rFVIIa 的患者在扩展部分期间concizumab 的耐受性也很好。尽管在 explorer4 或 explorer5 期间没有 TE,但它是一个重要的安全考虑因素。BAY1093884 的开发过程中、emicizumab 试验治疗期间及短干扰 RNA 偶联物 fitusiran均出现TE,导致试验终止或改变适应症。
ADA(抑制性抗体)的发展是血友病患者因子替代疗法的一个关键限制。在 explorer4 和 explorer5 试验中,concizumab 的长期治疗表现出可接受的免疫原性。尽管 25% 的患者在延伸部分发生 ADA,但大多数是低滴度和短暂的,未观察到临床效应。1 名患者在严重创伤事件后出现了具有高滴度中和活性的 ADA,由于临床过程复杂,ADAs 对该患者的临床影响尚无定论。
Concizumab与试验期间患者报告结局改善有关,特别是在身体功能、活力和疼痛方面。尽管在这两个患者群体中都观察到了改善,但有抑制性抗体的患者的改善幅度更大,反映了这些患者基线时生活质量较低。在评估血友病患者生活质量的改善情况时,一个关键的考虑因素是对关节病的影响。在 2 期 concizumab 试验期间观察到的身体功能的改善反映了对关节病的潜在积极影响,值得在未来的临床试验中进一步研究。
总之,2 期 explorer4 和 explorer5 试验的扩展部分结果与主要部分结果一致,为 concizumab 每日一次皮下注射治疗所有亚型血友病提供支持。正在进行的 explorer7 和 explorer8 3 期临床试验将进一步探索 concizumab的安全性和有效性。