2022年7月10日,Pliant Therapeutics(简称“Pliant”)公布了PLN-74809 在特发性肺纤维化 (IPF) 患者的2a 期INTEGRIS-IPF试验阳性数据。试验达到了主要和次要终点,PLN-74809 在 12 周治疗期内具有良好的耐受性,并显示出良好的药代动力学特征;该试验的探索性疗效终点评估用力肺活量 (FVC) 和定量肺纤维化 (QLF) 成像的变化,在 PLN-74809 治疗的患者中,与安慰剂相比,在 12 周内对 FVC 和 QLF 的治疗效果显示出剂量依赖性。

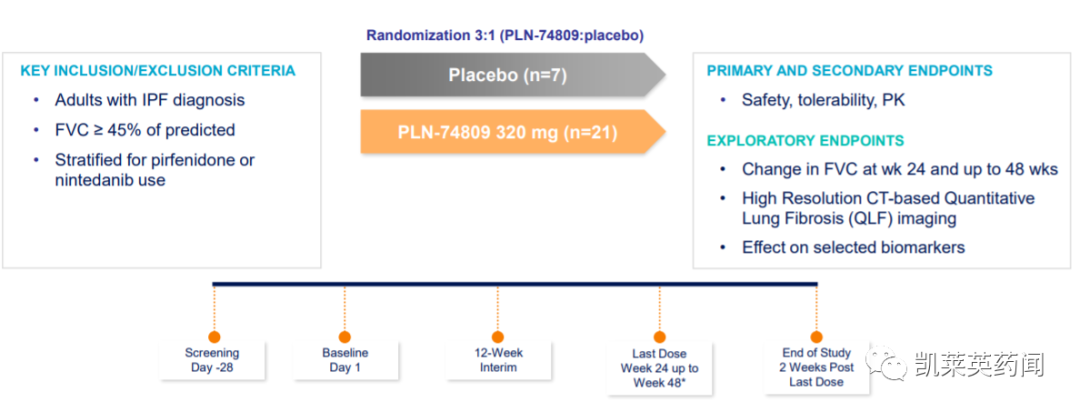
INTEGRIS-IPF是一项随机、双盲、安慰剂对照的多国研究,在 90 名 IPF 患者中评估PLN-74809 每天一次40 mg、80 mg、160 mg或安慰剂开展,为期 12 周。其中67 名患者被纳入治疗组,23 名患者被纳入安慰剂组。主要终点是评估PLN-74809的安全性和耐受性,次要终点是评估药代动力学。探索性终点将测量6个月治疗后FVC、基于HRCT的QLF和选定生物标志物的变化。
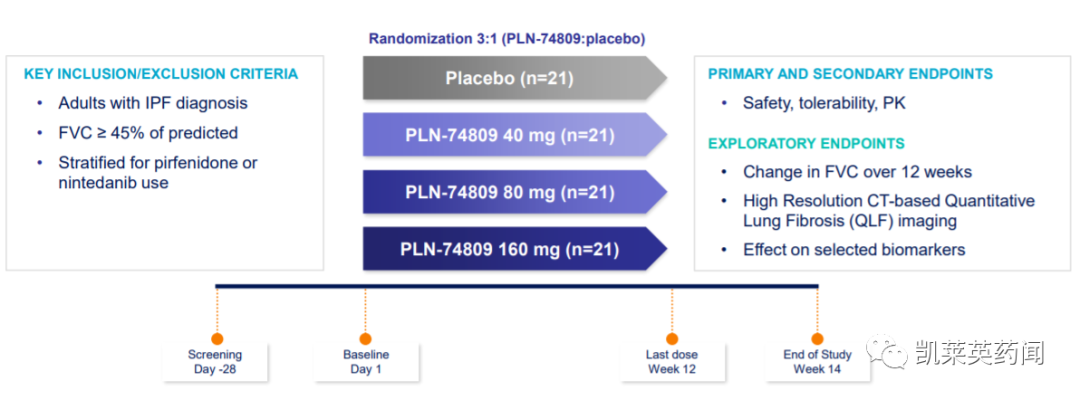
结果显示:
PLN-74809 在所有三种测试剂量下均具有良好的耐受性。在接受 PLN-74809 治疗的 67 名患者中,65 名(97%)完成了 12 周的治疗,没有因不良事件而停药。没有报告死亡或与药物相关的严重不良事件(SAE)。大多数治疗出现的不良事件 (TEAE) 的严重程度为轻度或中度。
PLN-74809 表现出血浆浓度的剂量比例增加,与先前的研究一致。
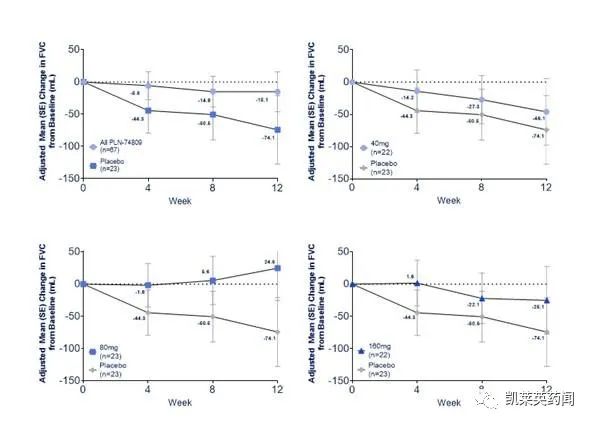
探索性终点显示:与安慰剂相比,12 周时 FVC 下降减少了 80%(PLN-74809汇总组为-15.1 mL,安慰剂为-74.1 mL)。与安慰剂相比,40 mg 和 160 mg 剂量组的FVC 下降分别减少了 38% (-46.1 mL) 和66% (-25.1 mL)。重要的是,在 80 mg 治疗组中,观察到 FVC 相对于基线增加了 +24.6 mL。
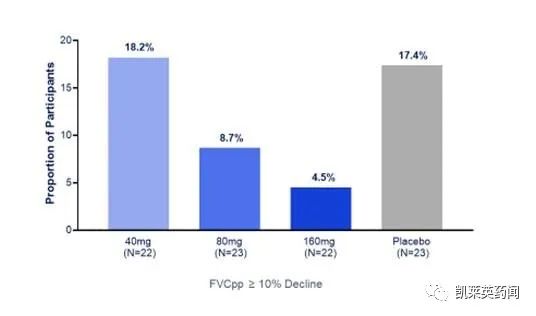
在治疗组中观察到FVCpp下降≥10%的患者比例呈剂量依赖性下降:在40 mg、80 mg和160 mg治疗组中,分别有18.2%、8.7%和4.5%的患者FVCpp下降≥10%,而在安慰剂组中为17.4%。
QLF 评分的增加与肺纤维化的增加有关。40 mg、80 mg 和 160 mg治疗组在 12 周时 QLF 的平均百分比变化分别为 3.15%、0.70% 和 0.00%,而安慰剂组为 1.15%。
此外,Pliant 最近完成了INTEGRIS-IPF 2a 期试验的 320 mg 队列的注册;320 mg 队列的 12 周中期数据预计将于 2023 年初发布。
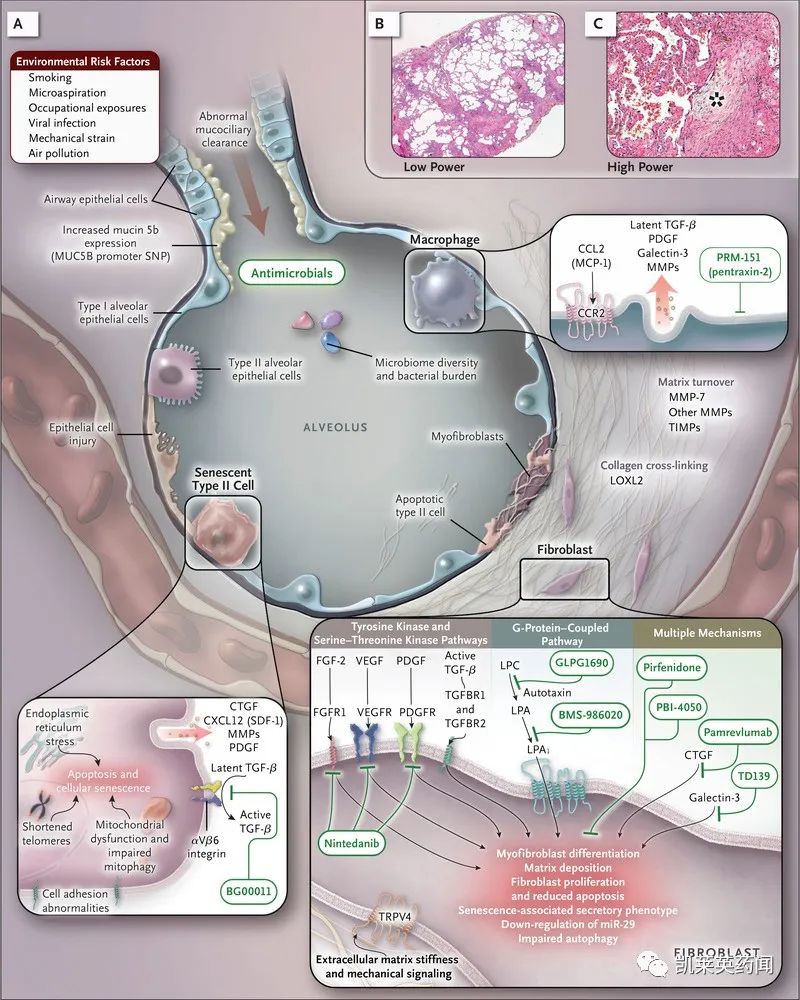
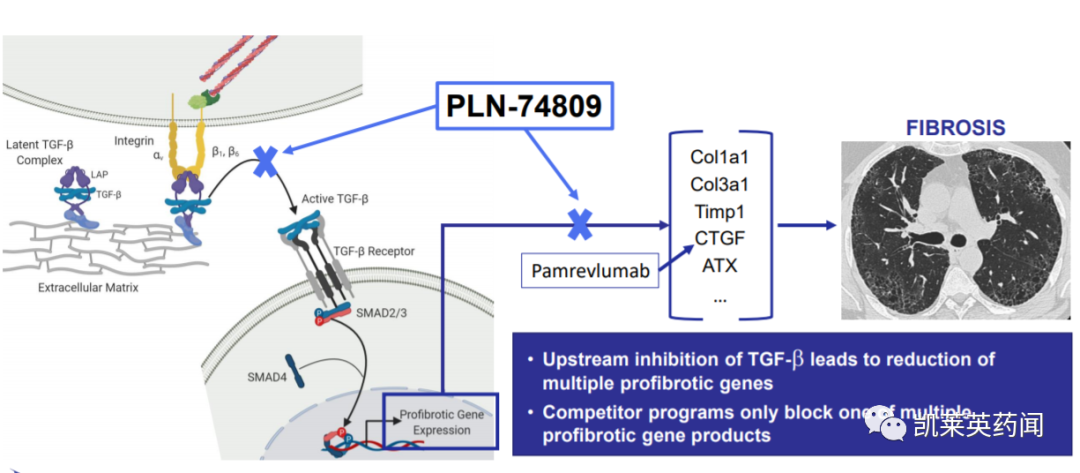
PLN-74809是一种口服小分子双重选择性抑制剂αvß6和αvß1整合素,这两种整合素在多种纤维化途径中起着关键作用,目前正在开发用于治疗特发性肺纤维化和原发性硬化性胆管炎(PSC),获得FDA在IPF和PSC适应症的孤儿药指定。在临床前研究中,PLN-74809能够改变只在纤维化组织中表达的特定整合素的功能,从而有针对性地阻断TGF-β激活,它可以防止,甚至可能逆转在肺部和肝脏中纤维化组织的生长。
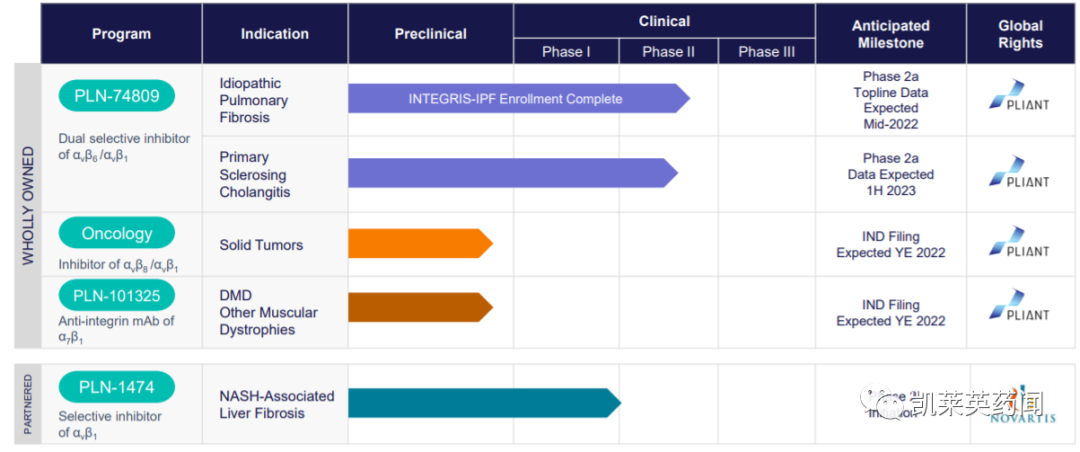
Pliant 是一家临床阶段的生物制药公司,专注于发现和开发治疗纤维化的新疗法。除PLN-74809外,Pliant还开发了一种小分子选择性αvß1抑制剂PLN-1474,用于治疗伴有肝纤维化的非酒精性脂肪性肝炎(NASH),目前已转让给诺华。除了临床阶段项目,Pliant还有两个针对肿瘤学和肌营养不良症的临床前项目。
IPF 是一种原因不明的慢性、进行性、纤维化肺病,治疗选择少,预后差,会使患者出现衰弱的症状,包括呼吸急促和难以进行日常活动,例如走路和说话。IPF是一种非常致命的罕见肺部疾病,60%-80%的患者在确诊后五年内死亡。目前,IPF 尚无药物治疗方法,两种已获批准的疗法均未证明有能力阻止 IPF 的进展。因此,对于新的治疗选择来解决症状和改变这种严重疾病的疾病进展存在高度未满足的需求。