
4月24日,在美国神经病学学会(AAN)年会上,阿斯利康/lonis公布了反义寡核苷酸(ASO)药物eplontersen的III期NEURO-TTRansform研究的详细数据,用于治疗遗传性转甲状腺素蛋白(TTR)介导的淀粉样变多发性神经病变(ATTRv-PN)。其中,在66周时,该研究达到了所有共同主要终点和次要终点。
| 关于NEURO-TTRansform研究
NEURO-TTRansform是一项全球性、开放标签、随机试验,旨在评估eplontersen治疗ATTRv-PN患者的疗效和安全性。该试验招募了168名患有ATTRv-PN1期或2期的成年患者,并将其与外部安慰剂组进行比较,这些安慰剂组来自Ionis于2017年完成的intertersen的neurottr注册试验。将eplontersen与外部安慰剂进行比较的最终分析在第66周完成,所有患者的治疗随访将持续至第85周,届时他们将可以选择过渡到开放标签扩展研究。
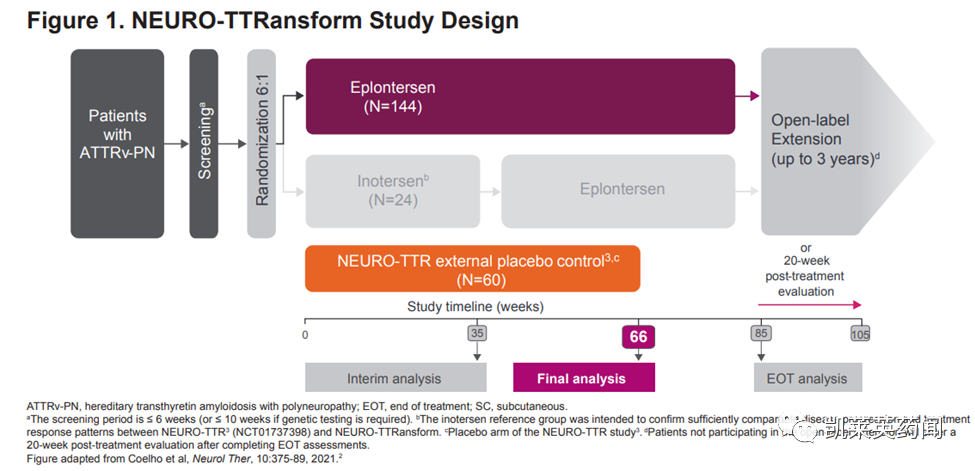
本次公布的重点数据如下:
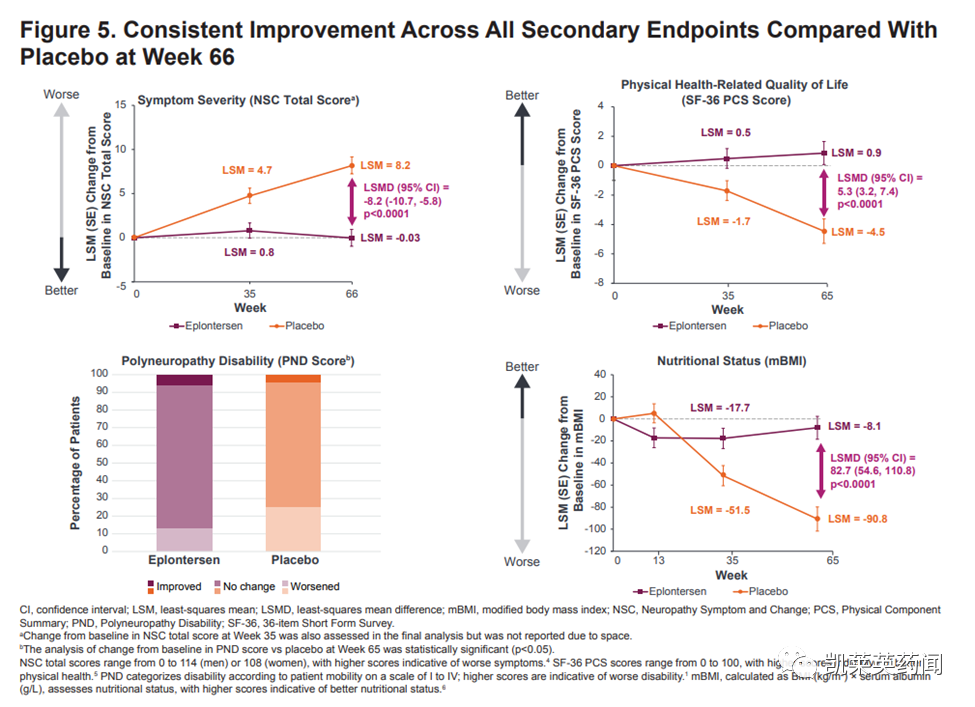
在66周时,接受Eplontersen治疗的患者在血清转甲状腺素(TTR)浓度、神经病变损害和生活质量的三个共同主要终点上表现出一致和持续的益处:
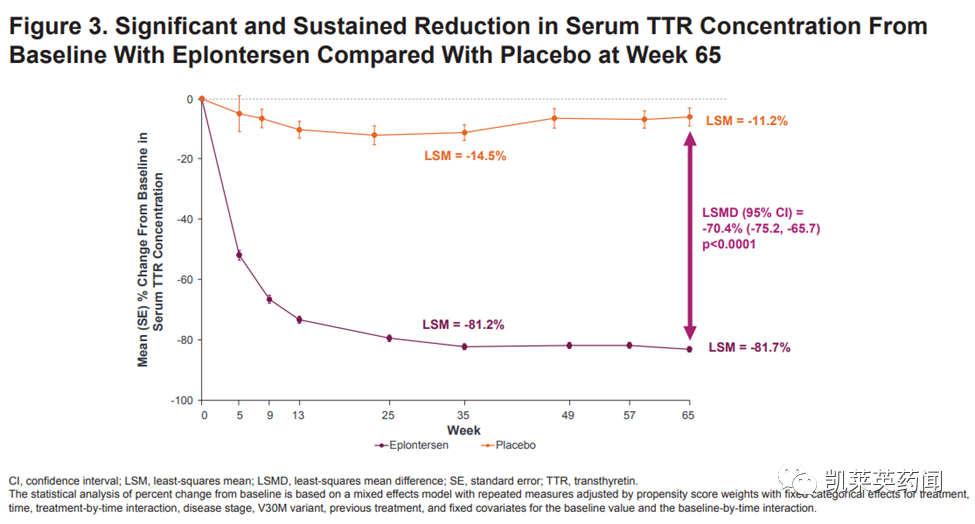
1)Eplontersen使血清TTR浓度从基线上平均减少82%,而外部安慰剂组从基线上减少11%(P<0.0001)。
2)Eplontersen阻止了疾病的发展,以改良神经病变损伤评分+7(mNIS+7)衡量,其结果是与基线相比只增加了0.28点,而外部安慰剂组从基线增加了25.06点(LS平均值改善24.8点;P<0.0001)。
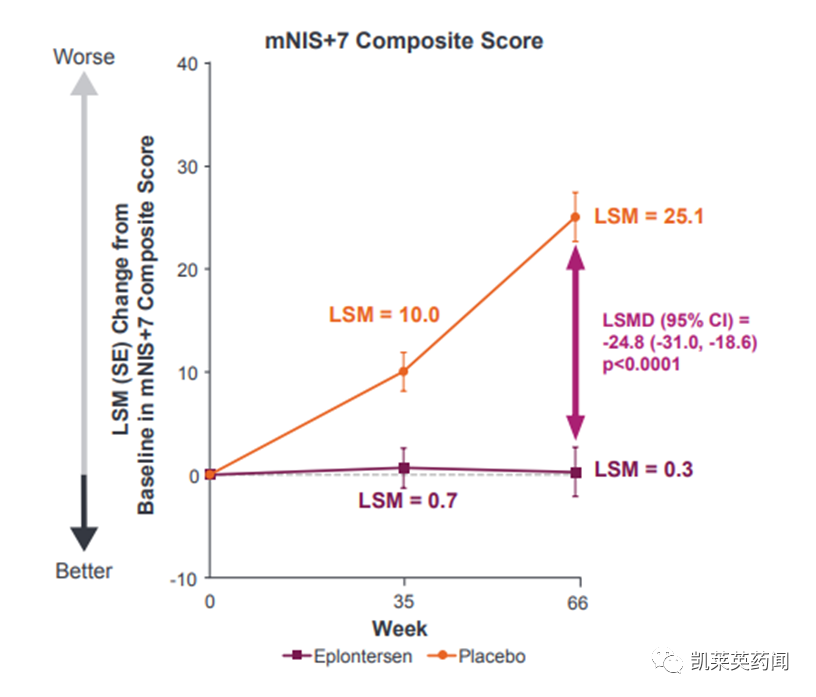
总的来说,与基线相比,47%的治疗患者在66周时的神经病变有所改善,而外部安慰剂组只有17%。在研究完成者中,与基线相比,53%的治疗患者在66周时神经病变有所改善,而外部安慰剂组则为19%。
3)Eplontersen改善了生活质量,在诺福克生活质量问卷-糖尿病神经病变(Norfolk QoL-DN)上显示了5.5点LS平均下降(改善),而外部安慰剂组则增加了14.2点(恶化)(19.7点LS平均改善;P<0.0001)。
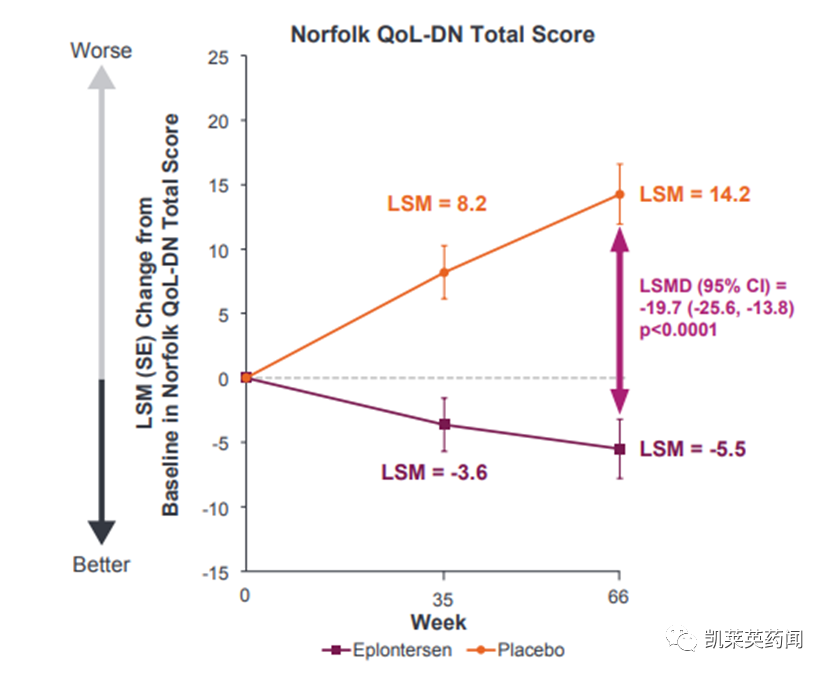
总的来说,与基线相比,58%的治疗患者在66周时显示出QoL的改善,而外部安慰剂组则为20%。在研究完成者中,65%的治疗患者在66周时与基线相比QoL有所改善,而外部安慰剂组只有23%。
Eplontersen在35周时对mNIS+7和Norfolk QoL-DN都有统计学意义上的益处,在66周时进一步改善。
4)此外,与外部安慰剂组相比,Eplontersen在所有次要终点上都取得了统计学意义上的改善。
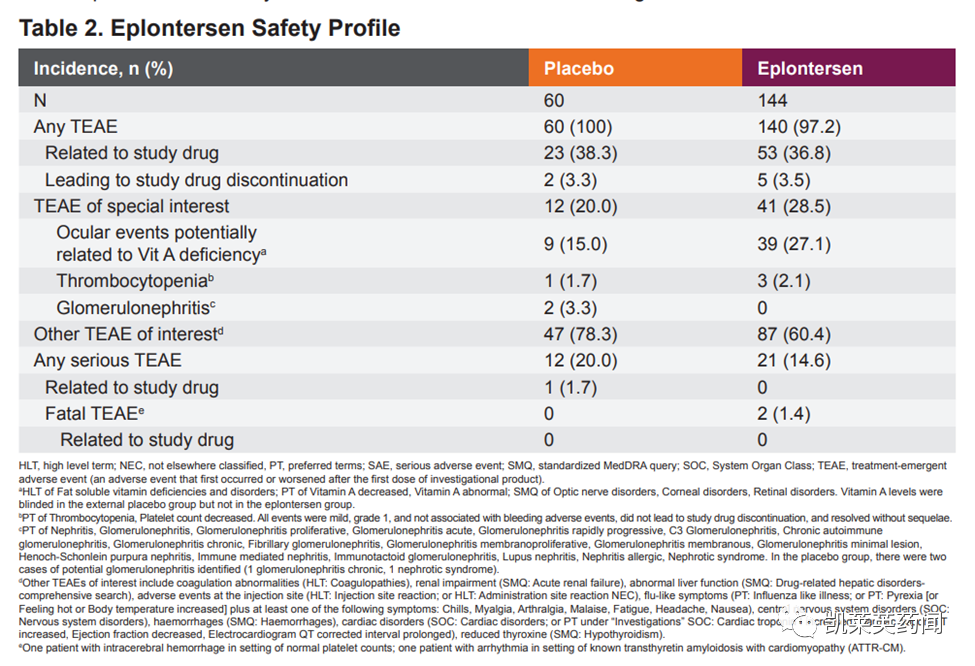
安全性方面,Eplontersen继续表现出良好的安全性和耐受性。eplontersen的治疗相关不良事件发生率与外部安慰剂组在所有主要类别上相当。没有药物相关的不良事件导致试验中断。
|关于eplontersen
Eplontersen是一款利用Ionis配体偶联反义(LICA)技术开发的在研反义寡核苷酸疗法,能有效地将ASO选择性递送到表达这些受体的细胞中,旨在减少甲状腺素转运蛋白或TTR蛋白的产生,以治疗所有类型的TTR淀粉样变性(ATTR)。
2021年12月,阿斯利康与Ionis签订了35.85亿美元共同开发eplontersen的合作协议。根据协议,Ionis将收到2亿美元的预付款、4.85亿美元的开发和监管里程碑付款,以及29亿美元的销售里程碑付款。

作为全球开发和商业化协议的一部分,Ionis和阿斯利康正在寻求美国监管机构批准eplontersen用于治疗ATTRv-PN,并计划寻求欧洲和世界其他地区的监管机构批准。2023年3月,美国食品药品管理局(fda)接受了eplontersen治疗ATTRv-PN的新药申请,PDUFA批准日期为2023年12月22日。2022年1月,Eplontersen在美国被授予孤儿药称号。
目前除了神经转化研究之外,Ionis公司还在全球3期心脏转化研究中对Eplontersen进行了评估,以研究用于治疗甲状腺素运载蛋白淀粉样心肌病(ATTR-CM)。ATTR-CM是一种全身性、进行性和致命的疾病,在发病后3至5年内会导致进行性心力衰竭和死亡。
|关于ATTR
遗传性甲状腺素转运蛋白介导的淀粉样多发性神经病(hATTR-PN)是一种罕见的遗传性疾病,是由转甲状腺素蛋白(transthyretin,TTR)错误折叠导致其在组织中异常沉积所致的系统性疾病,患者会经历全身神经持续衰弱损伤,导致运动功能渐进性丧失,如行走。这些患者还在其他主要器官中积累TTR,逐渐损害其功能。错误折叠的TTR蛋白积累造成的损害在诊断后五年内导致残疾,通常在十年内致命。
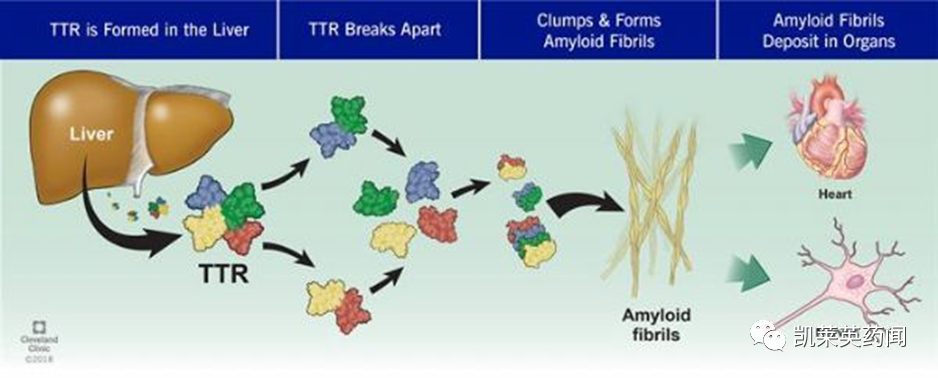
目前,全球有ATTR-CM患者30万~50万,ATTR-PN患者1万~4万。由于ATTR疾病具有发病率低、进行性加重、临床表现多样、鉴别诊断难度大等特点,国内对其认知尚在起步阶段,临床漏诊、误诊率高,患者确诊后生存期一般为2~15年,大部分患者将死于难治性心衰,造成了较重的医疗负担。

结合ATTR可能的发病机制,目前药物开发的策略包括:稳定TTR蛋白四聚体结构、修复突变或减少突变蛋白的生成、去除异常折叠的TTR蛋白。此前已有4 个药物获得了FDA用于该适应症的治疗,分别为patisiran(商品名:Onpattro)、vutrisiran (商品名:Amvuttra)、inotersen(商品名:Tegsedi)和Tafamidis(商品名:Synonyms) ,2022年总销售额已经超过30亿美元。
已上市ATTR产品情况

AZ和Ionis认为,eplontersen或将成为“best-in-class”。eplontersen的特点之一是,它适合患者每月1次自行给药,而Onpattro——目前它的主要竞争对手——必须每3周在诊所静脉注射1次。Tegsedi也可以自行注射,但每7天注射1次。