近日,临床神经病学专刊《肌肉与神经》上发布了一项治疗肌萎缩侧索硬化症(ALS)患者的最新临床试验,IF为3.852,对此,南京百鑫愉医药进行了详细解读。
临床神经病学专刊《肌肉与神经》上发布了一项治疗肌萎缩侧索硬化症(ALS)患者的最新临床试验,IF为3.852。研究有力证明了口服依达拉奉在治疗的48周内耐受性良好,患者没有出现新的不良反应,为临床治疗方案提供了新路径!
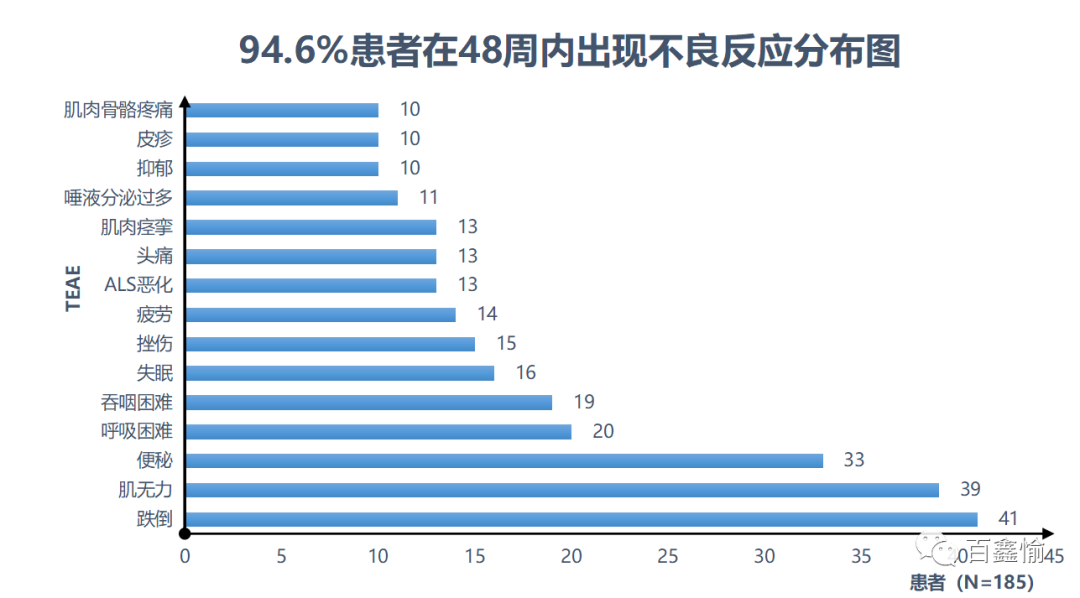
研究背景 在这项研究开始之前,美国已经批准了两种药物用于治疗肌萎缩侧索硬化症(ALS)的治疗:依达拉奉和利鲁唑。依达拉奉静脉注射剂在日本、美国和其他几个国家被批准用于治疗ALS,依达拉奉及早干预,提高ALS患者生活质量;持续使用,可显著延长ALS患者生存期,降低死亡风险。然而,静脉注射依从性差,增加安全隐患。 22年美国新上市了口服依达拉奉混悬液制剂,105mg剂量的口服依达拉奉与目前批准的60mg剂量的静脉依达拉奉具有相似的药代动力学特征,本研究的主要目的是评估口服依达拉奉治疗ALS患者的长期安全性和耐受性。 研究方法 ⚫ 研究设计 MT-1186-A01研究是一项全球性、多中心、开放标签、Ⅲ期临床研究,评估依达拉奉口服混悬液治疗ALS患者的长期安全性和耐受性。研究设计包括长达3周的筛选期,然后是48周的开放标签治疗期,其中包括最后一次给药后2周的安全随访期。完成后,所有患者均可选择转入开放标签扩展研究。 ⚫ 研究给药方法 患者接受105mg/5ml口服依达拉奉。治疗周期与静脉给药相同,静脉制剂以4周的治疗周期给药。最初的治疗周期包括每天60分钟给药,持续14天,然后是14天的无药期,随后的周期包括14天中的10天每天给药,然后是14天的无药期。 ⚫ 研究人群 纳入标准为:18~75岁男性和女性;根据El Escorial修订的Airlie House诊断标准,诊断为明确的、可能的、可能的实验室支持的或可能的ALS;基线用力肺活量(FVC)≥预测的70%;病程≤3y;能够独立工作。主要的排除标准是恶性肿瘤治疗或可能的恶性肿瘤活检结果悬而未决;存在任何可能影响研究目的或个人安全的临床重大疾病(ALS除外)或病史;谷丙转氨酶或天冬氨酸转氨酶升高上限>2倍筛选正常数量;对依达拉奉、依达拉奉的任何添加剂或非活性成分或亚硫酸盐过敏史;遗传性果糖不耐症;无法口服药物。 ⚫ 主要终点 评估了口服依达拉奉的安全性和耐受性,包括以下安全性评估:不良事件(AE),包括总治疗突发事件(TEAE)、严重TEAE、导致死亡的TEAE、导致研究药物停药的TEAE以及与研究药物相关的TEAE。额外的安全评估包括身体检查;体重;12导联心电图参数;生命体征;实验室安全评估;FVC预测百分比;麻木(通过访谈)、不稳(通过访谈)和振动感觉(通过使用音叉施加于脚踝外侧)的评估(临床意义异常报告为AE);哥伦比亚自杀严重程度评定量表(C-SSRS)在筛选、第12周、第24周和第48周使用CSSRS对患者进行评估。安全性分析人群定义为接受至少一剂研究药物的所有入组患者。口服依达拉奉的耐受性是根据不良反应发生率和因不良反应而停药来确定的。 研究结果 共有146名患者(78.9%)在最初的24周内报告了TEAE,175名患者(94.6%)在48周的研究期间报告了TEAE。到第24周,报告的TEAE最多的是肌肉无力、跌倒、疲劳、背痛、便秘、头痛和呼吸困难。48周结束时,报告最多的TEAE是跌倒、肌肉无力、便秘、呼吸困难、吞咽困难、背痛和失眠。16例(8.6%)患者因TEAE停药。到第24周,21例患者(11.4%)报告了严重TEAE,48例患者(25.9%)报告了严重TEAE(表S1)。到24周时,最严重的TEAE是ALS恶化、呼吸困难和呼吸衰竭。到48周时,最严重的TEAE报告为ALS恶化、吞咽困难、呼吸困难、呼吸衰竭、肺炎、体重下降和跌倒。在24周和48周时,只有1例患者报告了所有其他严重TEAE,并且在研究中没有显示出趋势。未见深静脉血栓形成或栓塞的TEAE报告。 到第24周和第48周,分别有36例(19.5%)和46例(24.9%)患者报告了研究者认为与研究药物相关的TEAE。到第24周,与研究药物相关的最常见TEAE是疲劳(n=6)、头晕(n=5)、头痛(n=4)和恶心(n=3)。到第48周,与研究药物相关的最常见TEAE是疲劳(n=6)、头晕(n=5)、头痛(n=4)和便秘(n=4)。在48周的研究期间,没有报告与研究药物相关的严重TEAE。 正如预期的那样,研究期间FVC逐渐下降。基线平均FVC为93.0%±15.4%,46例(24.9%)患者FVC<基线预测的80%。第24周时FVC的最小二乘(LS)平均基线变化为-11.9%(95%置信区间[CI]:-14.5%,-9.2%),第48周时为-25.1%(95%CI:-28.9%,-21.2%)。 对于大多数安全实验室参数,没有观察到患者数量从正常到异常值变化的趋势。生命体征、12导联心电图参数、体格检查、麻木不稳无明显变化。 根据C-SSRS评估,在研究治疗期间没有观察到自杀意念或行为的显著趋势。15例(8.2%)患者在其一生中报告有自杀意念或行为,22例(12.2%)患者在48周的研究期间报告有自杀意念或行为。 研究结论 在48周的治疗过程中,该研究表明口服依达拉奉耐受性良好,没有发现新的安全性问题。该试验提供了支持口服依达拉奉使用的安全性数据,扩展了支持使用FDA批准的IV依达拉奉和最近批准的口服制剂的现有证据。 奉易达®-依达拉奉全球创新制剂 口服制剂的出现避免了因频繁输液可能导致的不良反应,有效提高了患者治疗的依从性和安全性,极大降低家属及医护人员护理难度,减轻患者经济负担,降低社会医疗资源使用。依达拉奉口服制剂和静脉注射剂呈生物等效,耐受性良好,没有出现新的不良反应,但口服混悬液仍存在着一定的局限性,譬如仍需吞咽容易呛咳、无法避免肝脏的首过效应等。 由北京天坛医院和南京百鑫愉公司联合研发的奉易达®-依达拉奉舌下片,不仅与依达拉奉注射液生物等效(舌下含服两片等效静脉滴注60分钟),且无首过效应,长期用药无蓄积,更加便捷安全!